|
MATÉRIA: . Transformações Químicas . Misturas – heterogéneas e homogéneas (soluções) . Combustões . Ácidos e Bases . Escala de PH . Solubilidade de Sais . Lei de Lavoisier . Factores que alteram a velocidade da reacção química (catalisadores + e -) . Constituição da Matéria . Estados Físicos da Matéria . Átomos e Moléculas . Constituição do átomo . Iões e Substâncias Iónicas 1. TRANSFORMAÇÕES QUÍMICAS TRANSFORMAÇÕES QUÍMICAS → aparecimento de novas substâncias ↓ . por acção do calor (termólise) . por acção da luz (fotolise) . por acção mecânica . por acção da electricidade (electrolise) . por junção de substâncias (contacto) DETECTADA POR: ↓ - aparecimento de substâncias no estado gasoso; - aparecimento de chama; - aparecimento de novas cores; - aparecimento de novos odores; - alteração da temperatura; - aparecimento de um sólido (precipitado). 2. MISTURAS Substância pura + substância pura à mistura Substância Pura – composição fixa em proporções definidas. Mistura – composição variável em substâncias puras.
3. REACÇÕES DE COMBUSTÃO Uma reacção de combustão é uma reacção química que ocorre entre um combustível (o que faz arder) e um comburente (o que arde), existindo sempre libertação de energia. As combustões podem ser vivas (libertar luz e calor/chama) ou não. Nem sempre os produtos de reacção da combustão são água e dióxido de carbono. As combustões podem ser lentas como é o caso do enferrujamento de um prego (ferro). Exemplos de reacções de combustão:
4. ÁCIDOS E BASES Substâncias Ácidas . São substâncias que têm dissolvidos ácidos. . Têm sabor azedo, corroem metais, conduzem a corrente eléctrica. . Reagem com o calcário, corroendo-o e libertando dióxido de carbono . Tornam vermelha a tintura de tornesol. Substâncias Bases/Alcalinas . Designam-se muitas vezes por anti-ácidos por terem propriedades opostas aos ácidos. . São escorregadias, tornam vermelha (ou rosa) a solução de fenolftaleína. . Conduzem também a corrente eléctrica (tal como os ácidos) 5. ESCALA DE pH
À temperatura normal na Terra (de 20º a 25ºC): . menor valor de pH à mais forte é o ácido / pH < 7 . valor 7 de pH à substância neutra / pH = 7 . maior valor de pH à mais forte é a base / pH > 7 6. SOLUBILIDADE DE SAIS ácido + base (em igual quantidade) = SAIS Solubilidade: é a quantidade máxima de sal que pode ser dissolvida num litro de água. Exemplo de reacções de solubilidade:
. Há sais que se dissolvem bem na água (sais solúveis) e sais que se dissolvem muito pouco na água (sais insolúveis) . As reacções de precipitação são reacções em que se formam sais poucos solúveis em água. Estes sais pouco solúveis chamam-se precipitados. 7. LEI DE LAVOISIER
Massa dos reagentes = massa dos produtos de reacção Lei de Lavoisier: numa reacção química, a massa total das substâncias que nela tomam parte permanece constante.
8. FACTORES QUE ALTERAM A VELOCIDADE DAS REACÇÕES QUÍMICAS . Estado de divisão dos reagentes: quanto maior for o estado de divisão dos reagentes, maior é a velocidade das reacções. . Temperatura: pode alterar a velocidade das reacções químicas. . Concentração dos reagentes: quanto mais concentrados forem os reagentes mais depressa se dá a reacção. Efeito dos catalisadores: Catalisadores: são substâncias que alteram a velocidade das reacções químicas (mas, não se “gastam” nelas).. CATALISADORES . positivos: aumentam a velocidade da reacção. . negativos: diminuem a velocidade da reacção 9. CONSTITUIÇÃO DA MATÉRIA CONSTITUIÇÃO DA MATÉRIA: corpúsculos[1] microscópicos, com liberdade de movimentos e espaços vazios entre elas. ↓
A MATÉRIA É DESCONTÍNUA . A divisibilidade da matéria leva-nos a aceitar a existência de pequenos corpúsculos (partículas) . A matéria parece-nos contínua e compacta porque os corpúsculos que a constituem são tão pequenos que não os conseguimos ver. Teoria da Matéria: A matéria é constituída por corpúsculos microscópicos; os corpúsculos estão em constante movimento; entre os corpúsculos existem espaços vazios. 10. ESTADOS FÍSICOS DA MATÉRIA Os estados físicos da matéria caracterizam-se pelo grau de organização dos seus corpúsculos.
. Quando a temperatura de um gás aumenta (a pressão constante) o volume do gás aumenta.
. Pressão
. Se a temperatura aumenta (o volume constante) a pressão do gás aumenta. . Quando diminuímos o volume de um gás (a temperatura constante) a pressão aumenta. 11. ÁTOMOS E MOLÉCULAS . Os átomos são pequeníssimos corpúsculos constituintes da matéria. . Átomo é uma palavra de origem grega que significa indivisível. Hoje sabe- -se que os átomos são constituídos por partículas elementares ainda mais pequenas. . As moléculas são grupos de átomos. . Os átomos e as moléculas são unidades estruturais da matéria. . Os elementos representam-se por símbolos químicos. . Os átomos podem não se agrupar ficando apenas juntos e formando estruturas gigantes.
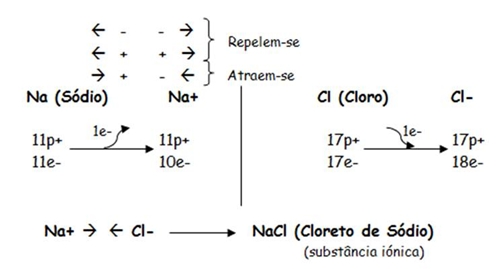
HISTÓRIA DA TEORIA ATÓMICA: Demócrito, filósofo grego (séc. V a.C.) referiu que a matéria era constituída por pequeníssimos corpúsculos indivisíveis (a que chamou átomos). John Dalton, químico inglês (1766-1844) retomou a ideia de átomo e defendeu a existência deste com base nos seus trabalhos experimentais. Segundo ele, os átomos poderiam combinar-se formando moléculas. MODELO ATÓMICO: Os átomos e as moléculas são representadas por umas esferas de cor e tamanho diferentes (modelo atómico). Um modelo é sempre uma representação da realidade e não a realidade (no caso dos átomos, eles não têm forma esférica mas representamo-los assim para ser mais fácil). Cada cor e tamanho de uma esfera do modelo atómico representa um átomo ou molécula diferente. moléculas diferentes à substâncias diferentes SUBSTÂNCIAS ELEMENTARES: Substâncias elementares: substâncias formadas por um só tipo de átomos (por átomos de um só elemento). Há substâncias elementares moleculares e outras que não formam moléculas. Exemplos de substâncias elementares moleculares: o oxigénio, o cloro, o hidrogénio, o azoto. SUBSTÂNCIAS COMPOSTAS: Substâncias compostas: substâncias formadas por mais do que um tipo de átomos (por átomos de 2 ou mais elementos). A maior parte das substâncias são substâncias compostas. Exemplos de substâncias compostas: a água, o dióxido de carbono, o amoníaco, o etanol (álcool etílico). SÍMBOLOS QUÍMICOS: Na Antiguidade, os alquimistas sentiram necessidade de encontrar uma simbologia para representar os elementos químicos. Decidiram representar os átomos dos diferentes elementos por desenhos inspirados na astrologia. O uso de símbolos apenas se veio a generalizar com Dalton em 1800. A simbologia hoje usada foi proposta pelo químico Berzelius em 1813. Berzelius propôs que os símbolos dos elementos químicos fossem apenas 1/2/3 letras do nome do elemento escrito em latim/grego/inglês, sendo a primeira letras maiúscula e as restantes minúsculas. FÓRMULAS QUÍMICAS: . Representam de forma simples e universal as substâncias elementares e compostas. . A fórmula química de uma substância molecular representa simbolicamente a constituição de uma molécula dessa substância. . Indica-nos a composição qualitativa (quais os elementos) e quantitativa (o número de átomos de cada elemento) da substância representada. 12. CONSTITUIÇÃO DO ÁTOMO Os átomos possuem um núcleo constituído por protões e neutrões (que se denominam nucleões). Em redor do núcleo movimentam-se os electrões. Os átomos são constituídos por: . protões: partículas do núcleo de um átomo com carga eléctrica positiva. . neutrões: partículas do núcleo de um átomo com carga eléctrica neutra. . electrões: partículas de um átomo com carga eléctrica negativa. Num átomo existem tantos protões como electrões. nº de cargas positivas = nº de cargas negativas Na totalidade, o átomo é electricamente neutro. Um átomo é identificado pelo nº de protões. Se se alterar o nº de protões altera-se o tipo de átomo. 13. IÕES E SUBSTÂNCIAS IÓNICAS IÃO à é um átomo que perde ou ganha electrões transformando-se numa partícula com carga (-/+). Se um átomo ganha electrões transforma-se num IÃO NEGATIVO (anião). Se o átomo perde electrões transforma-se num IÃO POSITIVO (catião).
As substâncias iónicas têm como unidade os iões. Como os iões têm carga eléctrica (+/-), as substâncias iónicas:
. Na fórmula química de uma substância iónica primeiro escreve-se o ião positivo (+) e depois o ião negativo (-). . No nome lê-se primeiro o ião negativo (-) e depois o positivo (+). . A totalidade da carga é 0. Ião poliatómico: grupos de átomos que perdem ou ganham electrões.
[1] Corpúsculos = partículas
Outros Trabalhos Relacionados
|
|
|||||||||||||||||