|
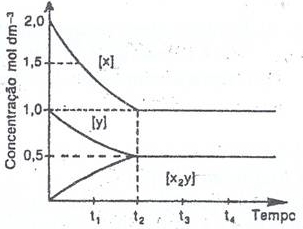
1. O gráfico da fig. ao lado, representa a variação das concentrações de reagentes e produtos no decorrer da reacção: 2X (g) + Y (g) ↔ X2 Y(g)
1.1. Indique as concentrações de todas as substâncias no equilíbrio. 1.2. Calcule a constante de equilíbrio. R: 1,0 2. Um recipiente de 12 dm3 de capacidade contém em equilíbrio, 83,4 g de PCl5, 7,75x10-2mol de PCl3 e 127,8 g de cloro a uma certa temperatura. M(PCl5) = 208,5gmol-1 PCl5 (g) ↔ PCl3 (g) + Cl2 (g) Calcule o valor da constante de equilíbrio. R: 2,9x10-2 3. Num recipiente de 1,0 L de capacidade, introduzem-se 2 mol de X e 1 mol de Y. O equilíbrio é atingido após a reacção de 75% de Y. 2X (g) + Y (g) ↔ X2 Y(g) Calcule as concentrações no equilíbrio e a constante de equilíbrio. R: 12 4. A 600K, o valor do Kc para o sistema: CO (g) + H2O (g) ↔ CO2 (g) + H2 (g) é de 302. Supondo que se introduziu num balão de 0,50 dm3, 2 mol de CO e 2 mol de H20, determine as concentrações de C02 e de CO no estado de equilíbrio. R: 3,8 moldm-3; 0,228 moldm-3 5. Considere o equilíbrio químico: A2 (g) + B2 (g) Û 2AB (g) Observações experimentais permitiram verificar que os valores da constante de equilíbrio variam em função da temperatura, de acordo com o quadro.
5.1. Classifique as afirmações seguintes em verdadeiras ou falsas e transcreva as falsas devidamente corrigidas. A – Um aumento de temperatura faz deslocar o equilíbrio no sentido 2. B – A reacção é endotérmica no sentido 1. C – Estabelecido o equilíbrio, qualquer variação de temperatura não altera o valor da constante de equilíbrio. 5.2. Verifica-se que no referido equilíbrio, à temperatura de 1000ºC, os valores das concentrações são: [A2] = 2 mol dm-3 [B2] = 2 mol dm-3 [AB] = 3 mol dm-3 Indique a expressão da constante de equilíbrio e calcule o seu valor. 5.3. Se o valor do quociente de reacção (Q) for de 10,0 à temperatura de 1000ºC, em que sentido se está a deslocar o equilíbrio? Justifique. 6. Determine o valor da constante Kc para o equilíbrio no estado aquoso. 2 A + 3B Û 3C + D sabendo que no equilíbrio [A] = 0,2 mol/dm3¸[B] = 0,1 mol/dm3 e que se consumiu 0,3 mol/dm3 da substância B. R: 67,5 7. Aqueceram-se a 500 K, 6 mol de PCl5(g) num vaso fechado de 10 L de capacidade. Parte do PCl5, decompôs-se em PCl3 (g) e Cl2 (g) numa transformação endotérmica. Quando se atinge o equilíbrio , o nº de moles de cloro presentes é de 1,0. M(PCl5) = 208,5gmol-1 7.1. Calcule a massa volúmica do gás inicial. 7.2. Determine a constante da reacção Kc a 500K. 7.3. Aumentando a temperatura, em que sentido se dá a reacção? R: 125g/L; 0,02 8. Considere a síntese do iodeto de hidrogénio, traduzida por: H2 (g) + I2 (g) ↔ 2HI (g) + 22,1 Kcal O rendimento de obtenção de HI aumenta quando: (escolha duas preposições certas) 8.1. Se aumenta a pressão do sistema. 8.2. Se diminui a temperatura. 8.3. se adiciona uma pequena quantidade de iodo sólido. 8.4. se aumentam as concentrações dos reagentes. 8.5. se aumenta a temperatura. 8.6. Justifique as preposições que considerou certas. 9. A 150ºC, para o equilíbrio representado por: N204 (g) (incolor) ↔ 2NO2(g) (castanho), a constante Kc tem o valor 3,20. No equilíbrio estão presentes 0,5 mol de N204 e 3,20 mol de NO2. Calcule o volume do recipiente.
Outros Trabalhos Relacionados
|
|