|
DO MODELO DO ÀTOMO ATÉ À TABELA PERIÓDICA Os vários modelos de átomo: 1. Modelo de Dalton – era uma esfera indivisível, só variava no tamanho, consoante o átomo. Baseou-se no modelo dos antigos gregos como Demócrito e Leucipo que acreditavam que a matéria é constituída por pequenas partículas. Após os antigos gregos, foi o 1º cientista que retomou a ideia de que o átomo era uma partícula indivisível e a mais pequena porção de matéria existente. 2. Modelo de Thomson. Era uma pequena esfera maciça carregada positivamente onde os electrões, já conhecidos, estavam incrustados como passas num bolo. (pudim de passas)
3. Modelo de
Rutherford. Chamado modelo planetário. A maior parte do átomo era
espaço vazio, no núcleo que ocupava um espaço reduzido, estava
concentrada a carga positiva, os electrões moviam-se à volta do núcleo a
grandes velocidades 4. Modelo de Bohr. Reconheceu a quantização da energia dos electrões no átomo, devido ao espectro do H ser descontínuo. Igual ao de Rutherford, mas já com níveis de energia determinados para os electrões. Reconheceu que os electrões giravam em “órbitas” bem definidas, mas sem caírem no núcleo. Concluiu que o raio das “órbitas”não era aleatório. Tinha valores múltiplos do quadrado de um nº inteiro. Concluiu também que se o e- percorre determinada uma determinada “órbita” não absorve nem emite energia, quando o e- absorve energia, transita de uma orbita mais interna para outra mais externa e vice-versa. Absorção ΔE>0 Emissão ΔE<0 Eradiação= Enível +elevado –Enível +baixo
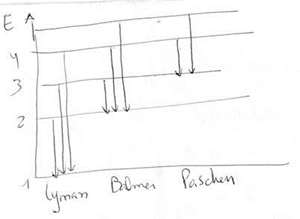
Mas o modelo tinha falhas: órbitas em lugar de orbitais, trajectórias fixas por onde passavam os electrões, não conseguiu interpretar as riscas espectrais para átomos polielectrónicos. 5. Modelo da nuvem electrónica. Constituída por orbitais, onde quanto maior a densidade, maior é a probabilidade de encontrar electrões. Para se chegar a este modelo, veio um cientista chamado Heisenberg que criou o princípio de Heisenberg. Não é possível conhecer com exactidão e simultaneamente a posição e energia do electrão num determinado momento. Se iluminarmos, alteramos a energia, se não iluminamos não vemos onde ele está. Só podemos falar em probabilidades. Foram Dirac e Heisenberg que deram origem ao modelo quântico com orbitais e nuvens electrónicas. Começa aqui a Mecânica Quântica, quando se sabe que não há posição exacta para o e-. Em lugar de falar em órbita, passa-se a falar em orbital, que é uma região do espaço onde sob a acção do núcleo, o e- tem uma certa probabilidade de se encontrar. Há um modelo matemático para a posição do electrão chamada equação de Schrodinger. Não há trajectórias. Nos átomos polielectrónicos em que n = 2, 3, 4, ….. há várias nuvens electrónicas, cada uma delas com várias orbitais. Para átomos só com um nível (H e He) só há uma orbital s esférica. Para átomos com 2 ou mais níveis, há outras orbitais com outros feitios. ÁTOMO DE H Já em 1900, Max Planck, verificou que os corpos incandescentes emitiam luz, chamou quantum à partícula mais pequena de energia, ou seja quantizou a energia (deixou de ser contínua). Estabeleceu uma fórmula para determinar a energia de uma quantidade de luz, utilizando uma constante (constante de Planck). Mais tarde Einstein aplicou o mesmo conceito à luz e chamou às partículas da luz “fotões”. Para conhecer a constituição do átomo de H, teremos que estudar o espectro de emissão de H. Para isso é necessário fornecimento de energia através de tubos onde se produzem descargas eléctricas. Só determinadas radiações (riscas), são emitidas, porque o electrão só pode ter determinadas energias. Essas riscas que são 4 (vermelho, azul, anil e violeta), constituem um espectro descontínuo ou espectro de riscas. Então só alguns estados de energia são permitidos para o electrão do átomo de H (estados estacionários). Compara-se como uma escada (não rolante), em que a bola ao descer a escada vai passando de degrau em degrau, nunca pode ficar entre degraus. São os níveis e têm determinados valores de energia. Ao nível mais baixo, chama-se estado estacionário de menor energia, também chamado estado fundamental. Aos outros chamam-se estados excitados porque lhe é fornecida energia, mas também são estados estacionários (de maior energia). Para explicar os espectros de riscas, Bohr admitiu que existem estados fixos de energia para o e- - estados estacionários, cada qual corresponde a um nível de energia. O e- nunca pode ter valores de energia nos intervalos entre os níveis. A energia está quantizada. Bohr formulou uma equação (só para o H) em que estabelecia quais os valores de energia possíveis no electrão do átomo de H, supondo os raios quantificados. Ee- = - 2,18x10-18 J/e- n2 Podem-se calcular as energias para os vários níveis de energia que são respectivamente: -2,17x10-18J; -5,42x10-19J 1º estado excitado; -2,41x10-19J 2º estado excitado; -1,35x10-19J;etc. Tem um valor sempre negativo, mas os valores vão sendo cada vez maiores até chegar a 0. (apesar de parecer o contrário, o sinal da base inverte a situação). A energia de um átomo = Ec + Ep A 1ª é devido à velocidade do electrão A 2ª é devido à interacção entre núcleos e electrões e entre electrões-electrões. O limite é E total=0, quando a Ec =0, porque está parado se o e- ainda não foi removido dado que o electrão saiu do átomo apenas (ainda sem Ec fora do átomo) e a Ep = 0 porque as interacções desapareceram e já não está sob a acção do núcleo. Quando E∞ (no infinito) E=0 Transição limite – Einc = Erem. H + E1 = H+ + 1e- o electrão é extraído VER PÁG 95 E mínima para remover no estado fundamental = 2,8X10-18j Erem= E∞-E1 Erem = 0 – (- 2,8x10-18J = 2,8X10-18j Erem= -Eelectrão= E1 A energia cinética fora do electrão pode ter quaisquer valores: não está quantizada. SÉRIES ESPECTRAIS E TRANSIÇÕES ELECTRÓNICAS NO ÁTOMO DE H Espectro de emissão do H As setas estarem para baixo significa que o electrão vem de cima para baixo, ou seja de um qualquer estado excitado para outro mais abaixo. Há uma emissão de energia.
. Se a risca parte de um nível qualquer para o nível 1 (estado fundamental), pertence à série de Lyman – radiação UV. . Se a risca parte de um nível qualquer para o nível 2, pertence à série de Balmer – radiação visível. . Se a risca parte de um nível qualquer para o nível 3, pertence à série de Paschen– radiação IV. MODELO QUÂNTICO DO ÁTOMO
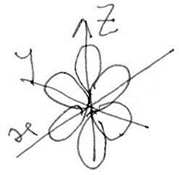
Quanto mais escura está a zona da nuvem, maior a possibilidade de encontrar o electrão. A nuvem é constituída por orbitais, com diferentes formas e com diferentes energias. Há 3 formas de orbitais. Para caracterizar uma orbital, são necessários 3 parâmetros: 1) n – nº quântico principal 2) l - nº quântico secundário, azimutal ou momento angular 3) ml – nº quântico magnético 1) significa o nº do nível (distância média ao núcleo); n=1, 2, 3 até 7 não completo. 2) L- significa a forma da orbital (0 a n-1) Se n=1; l=0 a orbital é esférica – s (simetria esférica) – o tamanho aumenta com o n. Se n=2; l=0 a orbital é esférica – s; l=1 a orbital é em forma de lóbulo ou altere – p 3) ml – relacionado com a orientação da orbital. Vai de –l a +l Ex: para l=0; ml= 0; Para l=1; ml= -1; 0; +1 3 orbitais segundo os 3 eixos coordenados px; py; pz para l=2, as orbitais são do tipo d e têm a forma de chupeta. Para l=2 ml= -2; -1; 0; +1; +2; (vai de -2 a +2). Cada nível começa sempre numa orbital s, a partir do nível 2 tem orbitais p e a partir do nível 3 tem orbitais s, p e d. Há uma orbital s, 3 orbitais p, 5 orbitais d, 7 orbitais f, etc. Cada orbital só pode ter 2 electrões, logo a orbital s tem 2 e-, as orbitais p têm 6 e-, as orbitais d têm 10 e-, etc. As orbitais s têm simetria esférica, o conjunto das orbitais p, têm também simetria esférica (ao lado).
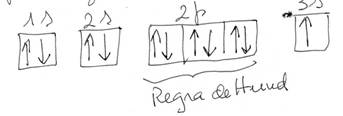
Indicam a orientação do e- na orbital. Pode ter os valores +1/2 e -1/2 conforme a seta está virada para cima ou para baixo. Spin significa o movimento de rotação sobre si próprio num sentido ou noutro (sentido dos ponteiros do relógio ou o oposto. No total há 4 nºs quânticos. CONFIGURAÇÕES ELECTRÓNICAS Há que atender a certas regras ou princípios para a distribuição dos electrões nos átomos. Princípios da energia mínima – Os electrões ocupam os estados de menor energia no estado fundamental. Só no estado excitado é que não. Princípio de exclusão de Pauli – Não podem existir mais de 2 e- numa orbital e têm que ter spins (rotações) opostos. Regra de Hund – Nas orbitais com a mesma energia (orbitais p e d), preenche-se 1º um e- em cada orbital e só depois se procede ao emparelhamento. Pode-se fazer o diagrama “normal” ou por diagramas de caixas. Já vimos que para as 3 orbitais p, os valores são -1;0; +1, segundo os eixos. Para as orbitais d que são 5, a representação por caixas dessas 5 orbitas é a seguinte: -2; -1;0; +1; +2 Pelo diagrama de caixas, a cada um destes valores corresponde um caixa, que pode ter no máximo 2 e- lá dentro com spins opostos. Ex: átomo de 3Li : 1s2 2s1 Através de diagramas de caixas:
Para o 11Na 1s2 2s2 2p6 3s1 ou 1s2 2s2 2px2 2py2 2pz2 Através de diagramas de caixas:
Estão aqui representados os 3 princípios ou regras. A ordem de preenchimento das orbitais em átomos polielectrónicos é: 1s, 2s, 2p, 3s, 3p, 4s, até ao cálcio de nº atómico 20. A partir daí, se o átomo tem mais de 20 e- , tem que seguir o diagrama de Pauling.
. Ex: Configuração electrónica do 16S pelas 2 maneiras. Indicar os 4 nºs quânticos do último electrão de valência a ser preenchido. . Indique a configuração electrónica de um átomo cujo último electrão de valência a ser preenchido, tem o seguinte conjunto de nºs quânticos: n=2; l= 1; ml= -1; ms= -1/2 EFEITO FOTOELÉCTRICO Os átomos e as moléculas recebem energia por diversos processos: descargas eléctricas, aquecimento ou absorção de radiação. Isso implica aumentar de energia dos seus electrões. Quando essa energia é suficientemente grande, o e- pode abandonar o átomo/molécula, deixando este de estar sob a acção do núcleo – REMOÇÃO ELECTRÓNICA. Consideremos uma chapa metálica. Se fizermos incidir fotões de determinado c.d.o. (baixo) e alta energia sobre esta, cada fotão arranca um e- da superfície do metal.
Para cada metal há uma frequência mínima abaixo da qual não há efeito fotoeléctrico. Corresponde também à energia mínima para arrancar o electrão do metal. 3 casos se podem dar: . O fotão incidente tem frequência igual à frequência mínima e o e- sai apenas (corresponde à energia de remoção do e-). f (fotão)= fmin E = hxfmin . O fotão incidente tem frequência superior à frequência mínima. O e- sai da placa com energia cinética. (excesso de energia). Acontece quando se usa uma radiação UV ou violeta mesmo de intensidade baixa. . O fotão incidente tem frequência inferior à frequência mínima. Não acontece nada. Acontece quando se utiliza fotões de baixa energia, por ex; luz visível, mesmo de intensidade baixa. Einc = W + Ec ou E = hxfmin + Ec (e-) ou = hxfmin+1/2 meve2 Importante: Desde que a frequência da radiação incidente seja igual ou superior à frequência mínima, quantos mais fotões interagirem com a placa metálica/unidade de tempo, maior será o nº de electrões arrancados a este. A luz tem carácter dualitário – ondulatório (na difracção) e corpuscular (no efeito fotoeléctrico). Aplicações do efeito fotoeléctrico Em fechos automáticos de portas, alarmes, máquinas fotográficas, sensores, elevadores, etc. Funcionamento: Quando a luz incidente é interrompida pela passagem de uma pessoa, deixam de ser ejectados electrões da célula, transmitindo-se um sinal para abrir a porta. ESPECTROSCOPIA FOTOELECTRÓNICA Em átomos polielectrónicos há e- em diferentes estados de energia (orbitais 1s, 2s, 2p, etc). As energias de remoção correspondentes variam conforme esses estados de energia.
Por ex: para o átomo de Na: Energia mínima = energia de remoção Para originar iões monopositivos pode ser removido 1 e- de qualquer estado de energia. Sabemos que para uma mesma radiação: Erad. = Erem + Ecinética Quando a Eremoção é maior, a Ec é menor e vice-versa. Se a radiação for suficientemente energética, vamos ter 4 energias cinéticas diferentes que nos permitem calcular as várias energias de remoção (4). O e- 3s é o que sai com maior Ec. Conhecem-se as energias dos electrões através de: Eelectrão = -Eremoção Técnica: Faz-se incidir um feixe de radiações altamente energéticas sobre a amostra. Os e- removidos passam por um campo eléctrico sendo tanto mais desviados quanto maior for a sua velocidade. O aparelho detector regista as diferentes velocidades. Velocidades → Ec →Erem→ Eelectrão Para se perceber exactamente o que se passa, vamos ilustrar com este desenho, que vai dar uma ideia de como tudo se processa.
A energia vai fazer saltar os e- em muitos átomos. É natural que a mesma energia nuns átomos arranca o e- mais interno (se for bastante energética), noutros arranque outro e- qualquer, o que no conjunto vai permitir obter um espectro com as várias energias de remoção do átomo. Umas vezes vai fazer saltar um e-, outras vezes outro, é uma questão de probabilidades. A Erad. é sempre igual, conforme o fotão faz saltar um ou outro e- , assim se vê a sua Ec, consequentemente a Erem. E consequentemente a E do electrão no átomo. Comparação: dar tiros, uma vez acerta num alvo, outras vezes perto desse alvo, outras vezes num alvo ali ao lado. O conjunto dos tiros é que vai acertar em todos os alvos. Mas o normal é que um fotão acerte num electrão. 2 fotões podem acertar em 2 e-, mas concerteza não são do mesmo átomo ???? TABELA PERÍODICA À medida que se iam estudando as propriedades dos elementos, foi necessário arrumá-los. Os elementos foram agrupados em metais e não metais. Na tentativa de arrumar os elementos, alguns cientistas vieram com algumas “leis”. . Lei das tríadas de Dobereiner descobriu grupos de 3 elementos com as propriedades (Li, Na, K), (Cl, Br, I), (Ca, Sr, Ba). . Lei das oitavas de Lothar Meyer que verificou que ao ordenar por ordem de massas atómicas, as propriedades dos elementos se repetiam de 8 em 8. . Mendeleev organizou a sua própria tabela com os elementos conhecidos (63), por ordem crescente das massas atómicas. Deixou lugares vazios para elementos ainda desconhecidos. Alterou a ordem de alguns elementos para que eles ficassem na coluna dos elementos semelhantes, embora a massa atómica assim não fosse crescente (Ge debaixo do Si). . Moseley identificou o nº atómico com a carga nuclear e esse nº crescente já coincidia com a ordem dos elementos na T.P. As propriedades dos elementos são uma função periódica do nº atómico. Actualmente a TP é uma versão completa da tabela de Mendeleev com 115 elementos. Relação entre as configurações electrónicas e a sua posição na T.P. Falar nos grupos, períodos e relacionar com as orbitais s, p, d, f. Períodos – nº quântico principal, corresponde ao nº de níveis. Grupos – nº de e- na orbital de valência. Apresentam propriedades químicas semelhantes Blocos s e p são representativos. O nº de e- de valência coincide com o algarismo das unidades do grupo. Têm orbitais s e p em preenchimento. Blocos d e f são elementos de transição. Têm orbitais d e f em preenchimento. PROPRIEDADES PERIÓDICAS Raio atómico – É a distância entre os centros de dois átomos ligados por ligação covalente. Depende de 2 factores: da atracção nuclear entre o núcleo e os electrões e da repulsão electrónica. Como varia na TP? Ao longo do período: diminui.
Também aumenta o nº de e-, o que conduz a uma maior repulsão e a um consequente aumento de raio atómico, mas este factor é menos importante que o 1º. Experimentalmente o que se nota é a diminuição do raio atómico. Ao longo do grupo: aumenta. O nº quântico principal aumenta, logo há mais orbitais, cada vez mais afastadas do núcleo. A atracção dos e- pelo núcleo é cada vez menor. Também os protões aumentam, por isso a carga nuclear também aumenta, mas este factor é menos importante que o 1º. Energia de Ionização – É a energia mínima capaz de remover um electrão. Energia de 1ª ionização – é a energia necessária para remover um e- de um átomo no estado fundamental e transforma-lo num ião monopositivo. X (g) + E1 → X+(g) + e- Energia de 2ª ionização é a energia necessária para remover um e- de um ião monopositivo no estado fundamental e transforma-lo num ião bipositivo. X+ (g) + E2 → X2+(g) + e- Energia de 3ª ionização - …………………. Etc.
Variação da energia de
ionização Aumenta ao longo do período – À medida que vai reduzindo o raio do átomo, mais difícil se torna remover o electrão, porque os electrões ficam cada vez mais atraídos pelo núcleo. Diminui ao longo do grupo - À medida que vai aumentando o raio do átomo, mais fácil se torna remover o electrão, por estar mais afastado do núcleo. Valores de energia de ionização para conhecer os e- de valência Ao arrancar sucessivamente e- de valência, a energia de ionização vai sendo cada vez maior. Enquanto forem da mesma ordem de grandeza, oe e- removidos pertencem todos ao mesmo nível. Se a ordem de grandeza passar a um valor mais alto, então os electrões removidos pertencem a um nível de energia mais interno. Ordens de grandeza diferentes: 2,0x102KJ e 5,5x103 ( o nº do expoente é superior) ou: se dividirmos o valor maior pelo menor, o quociente dá um valor que ultrapassa sensivelmente 3,3.
5,5x103
= 27,5 Exemplo para o alumínio (Al) pág. 97 I1, I2, I3 são da mesma ordem de grandeza, embora vão aumentando ligeiramente. Os electrões são do mesmo nível, o mais exterior. I4 e seguintes são de uma ordem de grandeza superior. Se dividindo o valor de I3 por I4 e der superior a 3,3, então são de O.G. diferentes. 192,6 = 4,23 45,5 Logo o Al tem 3 e- de valência pag. 99 e 100
Grupos Grupo I – Metais alcalinos Li, Na, K, Rb, Cs, Fr M → M++ 1e- Muito reactivos com a água a frio, são guardados em frascos com petróleo. Oxidam-se facilmente, todos acabam em s1, daí as propriedades semelhantes e o e- de valência. A reactividade aumenta ao longo do grupo porque o e- vai ficando cada vez mais longe do núcleo, saindo com mais facilidade. Para o Na: Outros Trabalhos Relacionados
|
|
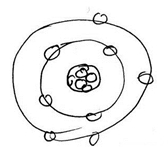 Não
havia restrições à energia do e- no átomo. Falhava na interpretação dos
espectros atómicos descontínuos e na teoria de Max Planck (1900) de que
numa carga acelerada, os electrões cairiam para o núcleo. Os electrões
ocupavam órbitas.
Não
havia restrições à energia do e- no átomo. Falhava na interpretação dos
espectros atómicos descontínuos e na teoria de Max Planck (1900) de que
numa carga acelerada, os electrões cairiam para o núcleo. Os electrões
ocupavam órbitas.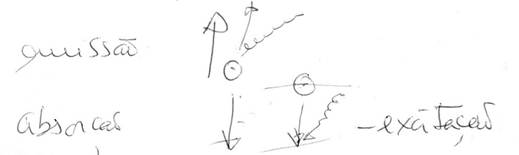
 Ao
contrário do que afirmava Bohr só existem probabilidades de localização
e não trajectórias fixas, o que dá origem a nuvens electrónicas.
Ao
contrário do que afirmava Bohr só existem probabilidades de localização
e não trajectórias fixas, o que dá origem a nuvens electrónicas.
 Para
os electrões de cada orbital ainda existe mais um nº quântico (ms), nº
quântico de spin
Para
os electrões de cada orbital ainda existe mais um nº quântico (ms), nº
quântico de spin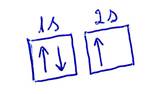

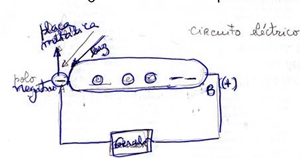 Interpretação:
Cada fotão de luz ao incidir na placa interage com um e-
transferindo-lhe a energia que transporta. Se a energia é suficiente, o
e- é arrancado à placa metálica.
Interpretação:
Cada fotão de luz ao incidir na placa interage com um e-
transferindo-lhe a energia que transporta. Se a energia é suficiente, o
e- é arrancado à placa metálica.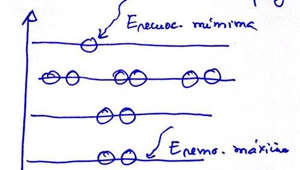 Para
uma mesma luz incidente são extraídos e- com diferentes E
Para
uma mesma luz incidente são extraídos e- com diferentes E
 Se
aumentar o nº de protões, aumenta a carga nuclear, então os e- são mais
atraídos pelo núcleo, fazendo contrair a nuvem electrónica.
Se
aumentar o nº de protões, aumenta a carga nuclear, então os e- são mais
atraídos pelo núcleo, fazendo contrair a nuvem electrónica.