|
Introdução: Com este trabalho pretendemos aprofundar os nossos conhecimentos da Tabela Periódica. Conhecer a sua história, e quem a organizou. Como foram criados os grupos, períodos e a disposição dos elementos. Quais as características dos grupos e dos períodos. Quais os elementos de transição e elementos representativos. Conhecer os diferentes grupos. Quais os metais e não metais. As propriedades dos elementos e a sua Periocidade. Existem mais famílias de elementos, neste trabalho só vamos falar sobre as quatro principais: Família dos Metais Alcalinos, dos Metais Alcalino-Terrosos, dos Halogéneos e dos Gases Nobres. História da Tabela Periódica No mundo que nos rodeia encontra-se uma enorme diversidade de materiais e de substâncias que os constituem. Mas, a grande variedade de substâncias obtém-se a partir de um número muito mais reduzido de elementos químicos que, actualmente, se encontram organizados numa tabela – a Tabela Periódica dos Elementos (TP). Um pré-requisito necessário para construção da tabela periódica, foi a descoberta individual dos elementos químicos. Embora os elementos, tais como ouro (Au), prata (Ag), Estanho (Sn), cobre (Cu), chumbo (Pb) e mercúrio (Hg) fossem conhecidos desde a antiguidade. A primeira descoberta científica de um elemento, ocorreu em 1669, quando o alquimista Henning Brand descobriu o fósforo. Durante os 200 anos seguintes, um grande volume de conhecimento relativo às propriedades dos elementos e seus compostos, foram adquiridos pelos químicos. Com o aumento do número de elementos descobertos, os cientistas iniciaram a investigação de modelos para reconhecer as propriedades e desenvolver esquemas de classificação. Antoine Lavoisier Antoine Lavoisier (1770/1789) nasceu em Paris e foi um químico Francês considerado o “pai” da Química. . Foi o primeiro cientista a enunciar o princípio da conservação da matéria; . Identificou e baptizou o Oxigénio; . Escreveu a primeira lista extensiva que continha 33 elementos; . Distinguiu metais de não metais (Fig. 1); . Contestou a teoria Flogística (segundo o químico Stahl os corpos combustíveis possuiriam uma matéria chamada flogisto, libertada para o ar durante os processos de combustão.); . Participou na reforma da momenclatura química. Foi Lavoisier que descobriu que a água é uma substância composta, formada por dois átomos de Hidrogénio e um átomo de Oxigénio (H2O). Em 1789, Lavoisier formulou a conservação da matéria - “Na Natureza nada se perde, nada se cria, tudo se transforma”.
Fig. 1 – Pequena parte da tabela de classificação dos elementos publicada por Lavoisier Jöns Jakob Berzelius Jakob Berzelius (Fig. 2) nasceu a 20 de Agosto de 1779 na Suécia, e faleceu em 1848. Foi um químico Sueco que se afirmou como um dos fundadores da Química moderna. . Durante uma década estudou cerca de dois mil compostos químicos, descrevendo vários elementos químicos até então desconhecidos, como por exemplo o Selénio (1817); . Separou pela primeira vez o Silício, o Zicórnio e o Titânio. . Introduziu os conceitos de isometria, halogéneos, acção catalítica e radical orgânico; . Construiu uma tabela de “pesos atómicos”; . Introduziu as letras para simbolizar os elementos. Jakob Berzelius estudou os fenómenos electroquímicos. Estudou o comportamento dos sais de alguns ácidos e dos sais de amónio. Determinou o peso atómico de 43 elementos, entre os quais, o Bário, o Silício, o Cálcio, etc. Determinou massas atómicas, e tomou o oxigénio como base, os resultados foram apresentados em 1818 numa tabela de massas atómicas de 42 elementos.
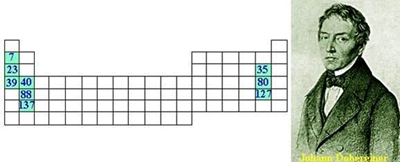
Fig. 2 – Berzelius num retrato pintado por Olof Johan Johann Döbereiner Johann Wolfgang Dobereiner, nasceu em Dezembro de 1780 e faleceu em Março de 1849, foi professor de química na Universidade de Lena. . Organizou as “tríades” (Fig. 3), grupo de 3 elementos com propriedades físicas semelhantes; . Iniciou a noção de grupo; . Contribuiu para o desenvolvimento da tecnologia dos vidros ópticos. Johann começou a estudar a lista dos elementos conhecidos, registando as suas propriedades e pesos atómicos, e acabou por descobrir dois grupos de elementos com o mesmo padrão.
Fig. 3 – Exemplo de umas das “tríades” criadas por Johann John Newlands John Alexander Newlands (Fig. 5) nasceu em 1837 e faleceu em 1898 foi um químico Inglês. . Organizou os elementos por ordem de “pesos atómicos; . Propôs a Lei da Oitavas (Fig. 4); . Iniciou a noção de período. John usou o exemplo das notas musicais (dó, ré, mi, fá,...) para ordenar os elementos químicos, pois esta foi uma tentativa de ordenação que mostrava uma certa periodicidade, apesar de muitos químicos não terem concordado com a ideia.
Fig.4 – Lei das Oitavas
Fig.5 – John Newlands Lothar Meyer Julius Lothar Meyer (Fig. 6) nasceu em 1830, em Varel, e morreu em 1895. Foi um químico Alemão. . Compilou uma tabela periódica de 56 elementos baseada na periodicidade das propriedades com o volume molar em função de “peso atómico”; . Procurou calcular o volume atómico dos elementos descobertos. Meyer e Mendeleev produziram as suas tabelas periódicas simultaneamente.
Fig.6 – Lothar Meyer Dimitri Ivanovich Mendeleev Dmitri Mendeleev (Fig.7) foi um professor universitário da Rússia que fez uma importante descoberta na história da Ciência, enquanto estava a escrever um livro de Química.
Mendeleev registou as propriedades de cada um dos elementos químicos
conhecidos (na época eram 63; hoje são mais de 100) em fichas de papel,
cada ficha para um elemento. Trabalhou as fichas, na tentativa de
encadear as ideias. Antes de escrever determinada parte da obra,
Mendeleev percebeu algo extraordinário. Apercebeu-se que nessa sequência havia intervalos regulares, elementos com propriedades semelhantes, de modo semelhante ao que Newlands tinha feito. Havia uma periodicidade, ou seja, uma repetição nas propriedades dos elementos. Entre os muitos exemplos de elementos com propriedades semelhantes, podemos evidenciar: . sódio (Na), potássio (K) e rubídio (Rb) - reagem explosivamente com a água; combinam-se com o cloro e o oxigênio formando, respectivamente compostos de fórmulas ECl e E2O (E representa o elemento); . magnésio (Mg), cálcio (Ca) e estrôncio (Sr) - reagem com água, mas não tão violentamente; combinam-se com o cloro e o oxigênio formando, respectivamente, compostos de fórmulas ECl2 e EO. Em 1869, Mendeleev pôde organizar os elementos numa tabela, onde os elementos com propriedades semelhantes apareciam numa mesma coluna. Organizou melhor a sua descoberta e percebeu que parecia faltar alguns elementos para que ela ficasse completa. Mendeleev resolveu, então, deixar alguns locais em branco nessa tabela, julgando que algum dia alguém descobriria novos elementos químicos que pudessem ser encaixados nesses locais, com base nas suas propriedades. Mendeleev até preveu algumas das propriedades que esses elementos teriam. Abaixo do silício, por exemplo, Mendeleev presumiu que deveria existir um elemento que ele denominou eka-silício (fig.8) e cujas propriedades preveu. Esse elemento foi descoberto em 1886 pelo alemão Clemens Winkler, que o chamou de germânio. As propriedades do germânio são muito próximas das previstas por Mendeleev. Admitiu que as massas atómicas de alguns elementos estavam erradas. Inverteu as suas posições, como por exemplo no caso do telúrio e do iodo.
Em 1871, ele publicou uma versão aperfeiçoada do seu trabalho.
Além do germânio, outros elementos cuja existência foi prevista por Mendeleev foram descobertos posteriormente como o escândio (Sc), o gálio (Ga) e o polônio (Po). E as propriedades desses elementos são iguais às previstas por ele ou bastante próximas.
Fig.7 – Dmitri Mendeleev
Fig. 8 – Tabela de comparação das Propriedades previstas por Mendeleev e as reais William Ramsay (Fig. 9) Descobriu os gases raros.
Fig.9 – Wiliam Ramsay Henry Moseley.... Lei Periódica Em 1913 e 1914, o inglês Henry Moseley (Fig. 10) fez importantes descobertas a trabalhar com uma complexa técnica envolvendo raios X. Ele descobriu uma característica numérica nos átomos de cada elemento que ficou conhecida como número atómico e que posteriormente foi associada ao número de protões. Os elementos não estão apresentados na tabela periódica actual por ordem crescente de massa atómica, mas sim por ordem crescente de número atómico. Hoje sabe-se que quando os elementos químicos são organizados em ordem crescente de número atómico, ocorre uma periodicidade nas suas propriedades, ou seja, repetem-se regularmente elementos com propriedades semelhantes. Essa regularidade da natureza é conhecida como Lei Periódica dos Elementos, de modo geral, à medida que o número atómico cresce, a massa atómica também cresce. Há apenas quatro casos de elementos consecutivos na tabela em que o de menor número atómico apresenta a maior massa atómica. Exemplos: . o árgon (18Ar), cuja massa atómica é 39,9 e está antes do potássio (19K), cuja massa atómica é 39,1; . o cobalto (27Co), cuja massa atómica é 58,9 e está antes do níquel (28Ni), cuja massa atómica é 58,7; . o telúrio (90Te), cuja massa atómica é 127,6 e está antes do iodo (53I), cuja massa atómica é 126,9; . o tório (90Th), cuja massa atómica é 232 e está antes do protactínio (91Pa), cuja massa atómica é 231. Apesar de na Tabela Periódica aparecerem muitos elementos que não eram conhecidos na época de Mendeleev, a ideia apresentada actualmente é a dele.
Fig. 10 – Henry Mosel Glenn Seaborg... O último retoque Glenn Seaborg (Fig. 11) foi quem fez a última modificação na tabela periódica, durante a década de 50. A partir da descoberta do plutónio em 1940, Seaborg descobriu todos os elementos transurânicos. Reconfigurou a tabela periódica colocando a série dos actnídeos abaixo da série dos lantanídeos. Em 1951, Seaborg recebeu o Prémio Nobel da química, pelo seu trabalho. E o elemento 106 tabela periódica é chamado seabórgio, como sua homenagem. O sistema de numeração dos grupos da tabela periódica (Fig. 12) , usados actualmente, é recomendado pela União Internacional de Química Pura e Aplicada (IUPAC). A numeração é feita em algarismos arábicos de 1 à 18, começando a numeração da esquerda para a direita, sendo o grupo 1, o dos metais alcalinos e o 18, o dos gases nobres.
Fig. 11 – Gleen Seaborg
Fig. 12 – Tabela Periódica com diferentes convenções A tabela periódica actual A Tabela Periódica (Fig. 13) é, efectivamente, um instrumento organizador de conhecimentos sobre os elementos químicos, onde estes estão ordenados por ordem crescente de número atómico (Z). É constituída por 116 elementos distribuídos em 7 linhas horizontais – períodos (azul), e 18 colunas verticais – grupos ou famílias (laranja).
Fig. 13 – Tabela Periódica com os períodos e grupos Períodos Nestas linhas observamos a classificação periódica crescente (da esquerda para a direita e de cima para baixo) dos elementos químicos em função dos seus números atómicos. Os elementos de um mesmo período têm o mesmo número de camadas electrónicas, que corresponde ao número do período. Os elementos conhecidos até ao cobre tem sete períodos, denominados conforme a sequência de letras K-Q, ou também de acordo com o número quântico principal- n. Os períodos são: . (1ª) Camada K - n = 1s . (2ª) Camada L - n = 2s . (3ª) Camada M - n = 3s . (4ª) Camada N - n = 4s . (5ª) Camada O - n = 5s . (6ª) Camada P - n = 6s . (7ª) Camada Q - n = 7s Grupos ou famílias Classificação nas linhas verticais dos elementos químicos. As colunas representam elementos químicos de propriedades semelhantes Existem 18 grupos sendo que o elemento químico hidrogénio é o único que não se enquadra em nenhuma família e está localizado naquela posição apenas por ter número atómico igual a 1, isto é, como tem apenas um electrão na última camada, foi colocado no Grupo 1, mesmo sem ser um metal. Os elementos de cada grupo tem uma configuração electrónica semelhante e possuem igual numero de electrões de valência, e são responsáveis pela semelhança de propriedades químicas que esses elementos apresentam. Os elementos do mesmo grupo formam uma família. Grupo 1 – Família dos metais alcalinos -(apresentam todos um electrão de valência – ns1) -Li (Lítio), Na (Sódio), K (Potássio), Rb (Rubídio), Cs (Césio), Fr (Frâncio) Grupo 2 – Família dos metais alcalinos-terrosos (os elementos tem dois electrões de valêncians2)- Be (Berílio), Mg (Magnésio),Ca (Cálcio), Sr (Estrôncio), Ba (Bário), Ra (Rádio) Grupo 17 – Família dos halogéneos (apresentam todos sete electrões de valência - ns2np5) - F (Flúor), Cl (Cloro), Br (Bromo), I (Iodo), At (Astato) Grupo 18 – Família dos gases nobres (apresentam todos oito electrões de valência - ns2np6 excepto o hélio.) - He (Hélio), Ne (Neônio), Ar (Argônio), Kr (Criptônio), Xe (Xenônio), Rn (Radônio)
Fig. 14 – Tabela Periódica as diferentes famílias Na tabela seguinte (Fig. 15), apresentam-se, de forma resumida, as propriedades que se destacam das famílias dos elementos acima apresentados.
Fig. 15 –Quadro com ascom Propriedades das diferentes famílias Metais
Um metal pode ser definido como um conjunto de átomos com carácter
metálico em que os electrões da camada de valência fluem livremente. Uma liga metálica é uma mistura com propriedades específicas, que contém no mínimo dois elementos metálicos. Exemplos de ligas: bronze (cobre e estanho, podendo conter outros elementos), duralumínio (alumínio e cobre, podendo conter outros elementos), latão (cobre e zinco), aço (ferro, carbono e outros). Aços inoxidáveis contêm: cromo, níquel e, em alguns casos, molibdénio, além dos elementos contidos nos aços normais. As principais características dos metais são : Maleabilidade: Capacidade que os metais têm de produzir lâminas e chapas muito finas. Ductilidade: Se aplicarmos uma pressão adequada em regiões específicas na superfície de um metal, ele pode transformar-se em fios e lâminas. Condutibilidade: Os metais são excelentes condutores de corrente eléctrica e do calor. Os metais possuem a capacidade de conduzir calor e electricidade de 10 a 100 vezes mais rápido do que outras substâncias. Exemplos: Os fios de transmissão eléctrica são feitos de alumínio ou cobre, panelas que usamos para cozinhar alimentos são feitas de alumínio. Brilho: Os electrões livres localizados na superfície dos objectos de metal absorvem e irradiam a luz, por isso os objectos metálicos, quando polidos, apresentam um brilho característico. Os Metais são quimicamente reactivos, ou seja, são muito instáveis. Desta forma, pode avançar-se que o carácter metálico aumenta ao longo de um grupo e diminui ao longo de um período. Assim sendo, o elemento com maior carácter metálico é o frâncio e o que tem menor carácter metálico é o flúor.
Fig. 16 – Mercúrio - um metal líquido Não metais Os Não-metais, segundo a classificação pelas propriedades de ionização e de ligação química, derivam do facto dos não-metais serem altamente electronegativos, isto é, de ganharem electrões de valência de outros átomos mais facilmente do que libertam os seus. A maior parte dos não-metais encontra-se na parte superior direita da tabela periódica. A excepção é o hidrogénio, que é em geral colocado na extremidade superior esquerda com os metais alcalinos, mas se comporta como um não-metal na maior parte das circunstâncias. Ao contrário dos metais, que são bons condutores de electricidade, um não-metal pode ser um isolador ou um semicondutor. Os não-metais podem formar ligações iónicas com os metais ao ganharem electrões, ou ligações covalentes com outros não-metais. Os óxidos dos não-metais são ácidos. Só existem 18 não-metais conhecidos, o que contrasta com mais de 80 metais, mas são os não-metais que constituem a maior parte da Terra, em especial das suas camadas exteriores. Os organismos vivos são compostos quase exclusivamente por não-metais Semi-metais Os semi-metais apresentam algumas propriedades dos Metais e outras dos Não Metais.
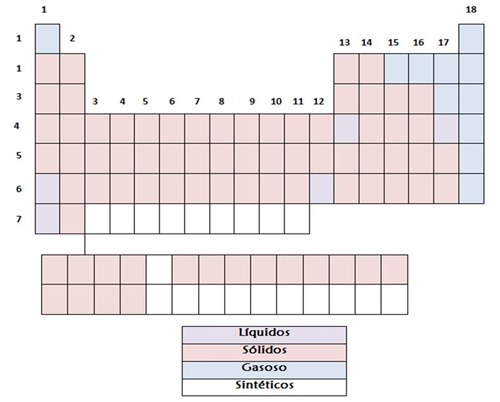
Fig. 17 - Tabela Periódica com os metais, semi-metais e não metais Estados Físicos (Fig. 18) A maior parte das substancias elementares encontram-se no estado sólido, excepto o Mercúrio (Hg) , Césio (Cs), Frâncio (Fr), Bromo (Br) e Gálio (Ga) que se encontram no estado Liquido e Hidrogénio (H), Azoto (N), Oxigénio (O), Flúor (F), Cloro (Cl) e os elementos do 18 grupo que se encontram no estado Gasoso.
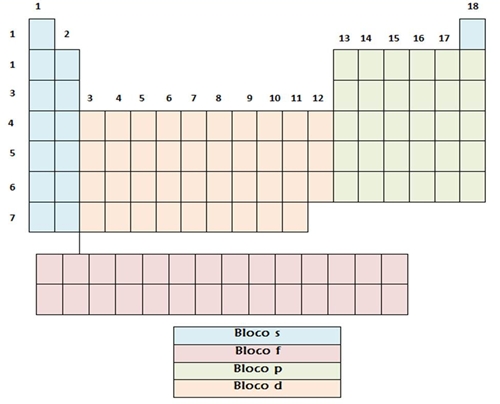
Fig. 18 -Tabela Periódica com os estados físicos Elementos representativos, de transição e os seus blocos A localização dos elementos na Tabela Periódica, está relacionado com a sua configuração electrónica. A Tabela Periódica pode ser dividida em blocos (Fig. 19) (bloco s, p, d e f), conforme o tipo de orbitais em que se encontram os electrões de valência. Os elementos representativos do grupo 1 e 2 constituem o bloco s. O bloco p integra as restantes famílias dos elementos representativos. Pode dizer-se que os elementos representativos são aqueles que têm as orbitais s ou p de maior número quântico principal incompletamente preenchidas. Quanto ao grupo 18, os elementos pertencem todos ao bloco p, à excepção do hélio, que tem configuração electrónica 1s2. Os elementos de transição correspondem ao bloco d. Por último, os elementos de transição interna, isto é, as séries dos lantanídeos (6º período) e dos actinídeos (7º período) representam o bloco f. É de notar que os elementos do bloco f são muito difíceis de distinguir, pois, por terem as orbitais f não completamente preenchidas, têm todos propriedades muito similares.
Fig. 19 – Tabela Periódica com os Blocos s, p, d, e f Propriedades periódicas dos elementos A variação periódica de algumas propriedades dos elementos – propriedades periódicas, depende das configurações electrónicas e, como tal, da posição dos elementos na Tabela Periódica. Os dois factores base que originam a variação dessas propriedades são: . o aumento do número quântico principal (n) das orbitais de valência ao longo de um grupo – factor que provoca o afastamento dos electrões de valência para níveis de energia sucessivamente mais afastados do núcleo (níveis de energia mais energéticos), o que favorece uma menor acção atractiva por parte dos protões que estão no núcleo; . aumento do número atómico (Z) ao longo de um período – factor que tem como consequência directa um aumento da carga nuclear, o que faz com que os electrões sejam mais fortemente atraídos pelo núcleo; contudo, os electrões não são atraídos pela carga nuclear total, mas sim pela carga nuclear efectiva – carga do núcleo enfraquecida pelas repulsões electrão-electrão. O conceito da carga nuclear efectiva permite ter em conta a influência da blindagem (Fig. 20) nas propriedades periódicas. A blindagem pode ser entendida como a protecção que os electrões das orbitais internas (electrões de blindagem) exercem sobre os electrões externos (electrões de valência), pois eles diminuem a atracção que o núcleo, naturalmente, exerce sobre os mesmos. Como é lógico, em átomos polielectrónicos as repulsões existentes entre os electrões também contribuem para a atenuação da força de atracção núcleo - electrões de valência.
Fig. 20 – Efeito de Blindagem Raio atómico O raio atómico (Fig. 21) é difícil de definir, pois a nuvem electrónica de um átomo não tem um limite preciso, mas compreende-se que depende da força com que os electrões exteriores são atraídos pelo núcleo. Para elementos metálicos, o raio atómico é metade da distância entre os dois núcleos dos dois átomos adjacentes. Para elementos que existem como moléculas diatómicas simples, o raio atómico é metade da distância entre os núcleos dos dois átomos do mesmo elemento unidos pela ligação química. Na Tabela Periódica o raio atómico varia da seguinte forma (Fig. 22): . aumenta ao longo de um grupo, porque como aumenta o número de níveis de energia preenchidos, há um maior afastamento dos electrões de valência ao núcleo, o que provoca um aumento no tamanho do átomo; . diminui ao longo de um período, porque, embora o número quântico principal das orbitais de valência se mantenha constante, a carga nuclear aumenta e prevalece em relação às repulsões que se fazem sentir entre os electrões; assim, as forças de atracção núcleo -electrões de valência são mais intensas, há contracção da nuvem electrónica e, consequentemente, o tamanho do átomo é menor.
Fig. 21 – Como determinar o raio atómico
Fig. 22 -Variação do raio atómico com o número atómico Ao observar o gráfico, pode-se concluir que, de uma forma geral, os átomos de menores dimensões constituem os elementos do grupo dos halogéneos e os de maiores dimensões são os metais alcalinos. É de destacar que nos lantanídeos, a diminuição do raio atómico é muito acentuada, pois enquanto a carga nuclear aumenta, os electrões vão sendo adicionados às orbitais 4f, pelo que são atraídos de forma cada vez mais significativa. Raio Iónico (Fig. 23) Como é de esperar, quando um átomo se transforma num ião (partícula com carga eléctrica) o seu tamanho sofre alterações. Os átomos têm tendência a transformar-se em iões para adquirem um mínimo de energia, ou seja, um máximo de estabilidade. Isto é conseguido quando a configuração electrónica do ião é igual à do gás nobre que lhe é mais próximo na Tabela Periódica. Se o átomo tem tendência a perder electrões origina um catião e o seu tamanho diminui, porque como a carga nuclear permanece igual e a remoção de um ou mais electrões reduz as repulsões electrão-electrão, a nuvem electrónica contrai-se. Se o átomo tem tendência a receber electrões origina um anião e o seu tamanho aumenta, porque os electrões adicionais favorecem a expansão da nuvem electrónica. O raio iónico nem sempre tem o mesmo valor, depende da estrutura cristalina em que o ião está inserido e da natureza e disposição dos iões vizinhos. O catião é sempre mais pequeno do que o átomo a partir do qual se formou.
O
anião é sempre maior do que o átomo a partir do qual se formou.
(Fig. 24)
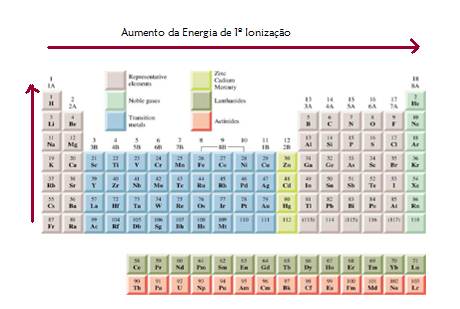
Fig. 24 –Raio Iónico Fig. 23 – Variação do Raio Iónico Energia de Ionização A energia de ionização é a energia mínima necessária para remover um electrão de um átomo no seu estado fundamental (átomo neutro), na fase gasosa. Portanto, a energia de ionização mede a maior ou menor facilidade com que um átomo perde um electrão: quanto maior for a energia de ionização, mais difícil é a remoção do electrão e vice-versa. A Energia da 1º Ionização está relacionada com a reactividade química: quanto mais difícil for retirar um electrão a um dado átomo, menos reactivo (mais estável) é o elemento químico correspondente. Nos átomos polielectrónicos existe mais do que um electrão, pelo que após arrancar o primeiro, é possível fornecer mais energia, agora ao ião monopositivo, para arrancar o(s) seguinte(s). Neste contexto, surgem as designações de primeira energia de ionização (ou somente energia de ionização), segunda energia de ionização (Fig. 25) e assim sucessivamente. À medida que aumenta a carga positiva do ião ao qual se pretende remover mais um electrão, as repulsões entre os electrões diminuem e estes são mais fortemente atraídos pelo núcleo. Por conseguinte, é cada vez mais difícil de remover o electrão. Consequentemente, as energias de ionização são sucessivamente crescentes. A primeira energia de ionização varia de forma regular na Tabela Periódica (Fig. 26): . ao longo de um grupo diminui, porque aumenta o número de níveis preenchidos e a distância dos electrões de valência ao núcleo e diminui a força de atracção núcleo-electrões de valência, sendo necessária uma menor quantidade de energia para arrancar o electrão; . apesar de alguma irregularidade, ao longo de um período aumenta, porque aumenta a carga nuclear e, consequentemente, a força de atracção núcleo-electrões de valência, sendo, então, necessária uma maior quantidade de energia para remover o electrão. De um forma geral, os metais têm energias de ionização (Fig. 27) mais baixas do que os não-metais. Através da figura 25 e 26 é, ainda, compreensível que os elementos que têm maior energia de ionização são os gases nobres, daí a sua inércia química, e os que têm menor energia de ionização são os metais alcalinos, pois, como têm configuração de valência ns1, isto é, têm apenas um electrão de valência que, por sua vez, está muito blindado, facilmente o perdem para adquirirem a configuração electrónica do gás nobre do período anterior. Os metais alcalino-terrosos têm energias de ionização um pouco superiores às dos metais alcalinos. De todos os elementos, o que tem maior energia de ionização é o hélio.
Fig. 25 – Variação das Energias de Ionização para os 20 primeiros Elementos
Fig. 26 – Variação da 1º Energia de Ionização ao longo do grupo e do período
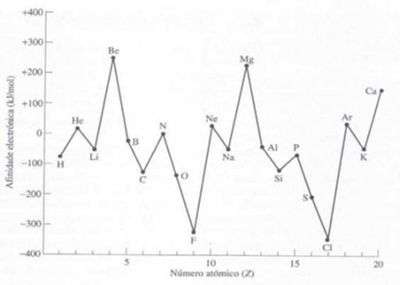
Fig. 27 – Variação da energia de ionização com o número atómico Nos elementos de transição, o aumento da energia de ionização ao longo de um período é apenas ligeiro, porque mesmo com o aumento da carga nuclear, o efeito de blindagem que os electrões internos 3d exercem sobre os 4s é maior do que o efeito de blindagem que existe entre os electrões da camada de valência (os electrões que são removidos em primeiro lugar são os da orbital 4s), fazendo com que a carga nuclear efectiva aumente muito lentamente entre elementos de transição consecutivos. Conjugando as duas propriedades já referidas conclui-se que variam numa forma inversa: quanto maior o raio atómico de um dado átomo menor é a energia de ionização do respectivo elemento químico e vice-versa. Esta relação faz todo o sentido, pois se o electrão está mais distante do núcleo é mais fácil arrancá-lo ao átomo. Afinidade Electrónica A afinidade electrónica depreende-se como a variação de energia que ocorre quando um electrão é captado por um átomo, no estado gasoso, para formar um ião mononegativo. Por convenção, atribui-se um valor negativo à afinidade electrónica quando há libertação de energia (se há libertação energia o anião é mais estável do que o átomo neutro). Quanto mais negativa for a afinidade electrónica, maior a tendência do átomo para receber um electrão. Em geral, ao longo da Tabela Periódica a afinidade electrónica (fig. 28): - diminui ao longo do grupo, embora de modo ligeiro; como aumenta o tamanho do átomo, os electrões estão mais distantes do núcleo e, como tal, são menos atraídos, pelo que o núcleo tem muita dificuldade em captar mais um electrão; - aumenta ao longo do período, porque o facto dos átomos terem cada vez maior carga nuclear significa que lhes é mais fácil atrair o electrão, à excepção dos gases nobres.
Fig. 28 – Variação da afinidade electrónica com o número atómico para os primeiros 20 elementos Ao observar o gráfico, verifica-se que: . as afinidades electrónicas dos metais são, geralmente, menores (mais positivas) do que as dos não-metais; . os halogéneos são os que têm maiores afinidades electrónicas (facilmente captam um electrão para adquirem a configuração electrónica do gás nobre) . os gases nobres não têm tendência a captar electrões (têm afinidades electrónica positiva), por terem todas as suas orbitais completamente preenchidas; . os metais alcalino-terrosos também não têm tendência para captar electrões. Como se previa, a afinidade electrónica varia na mesma razão da energia de ionização (se é mais difícil arrancar um electrão a um átomo, é porque ele facilmente capta electrões) e na razão inversa do raio atómico. Electronegatividade A Electronegatividade mede a tendência de um átomo para atrair os electrões quando está ligado quimicamente a outro átomo. Esta grandeza não pode ser medida directamente, mas compreende-se que está relacionada com a afinidade electrónica e com a energia de ionização do elemento em questão: um átomo com uma elevada afinidade electrónica e energia de ionização, possui uma Electronegatividade alta e vice-versa. A Electronegatividade: . diminui ao longo de um grupo, pois aumenta a facilidade com que os átomos cedem electrões; . aumenta ao longo de um período, porque diminui a tendência dos átomos para perderem electrões. Não esquecer que os metais de transição não seguem estas tendências (fig. 29).
Fig. 29 – Variação da Electronegatividade com o número atómico Através do gráfico observa-se que os átomos dos elementos metálicos têm Electronegatividade mais baixas do que os dos não-metais, sendo o flúor o mais electronegativo de todos. Números de oxidação O número de oxidação é o número de cargas que um átomo teria numa molécula se os seus electrões fossem completamente transferidos para o átomo mais electronegativo. Habitualmente, os números de oxidação correspondem à perda ou ao ganho de electrões, de modo a que os átomos adquiram uma configuração electrónica com as orbitais de valência completamente preenchidas. Para os elementos representativos, o número de oxidação relaciona-se estreitamente com a configuração electrónica de valência dos átomos. Os metais dos grupos 1 e 2 formam catiões com um único número de oxidação: +1 e +2, respectivamente. No grupo 13, todos os metais apresentam número de oxidação +3, mas o índio e o tálio também podem apresentar número de oxidação igual a +1. No grupo 14, 15, 16 e 17 os átomos, de quase todos os elementos, podem originar iões positivos (devido à perda dos electrões da orbital p do nível de valência) de carga variada, apresentando pois diferentes números de oxidação. Os números de oxidação negativos surgem no grupo 15, 16 e 17, porque os átomos têm uma grande tendência para receber electrões, de forma a completarem a orbital p do nível de valência. Os metais de transição têm vários valores de número de oxidação (ver Anexo 1), devido à presença de electrões nas orbitais d. Normalmente, todos eles incluem o número de oxidação +2, +3, ou ambos. Os números de oxidação +3 são mais estáveis nos grupos que se seguem ao grupo 3 e os números de oxidação +2 são mais estáveis nos grupos que imediatamente, antecedem o grupo 11. Isto verifica-se porque a energia de ionização aumenta ao longo do período, sendo necessária mais energia para remover os vários electrões. Assim, os átomos tendem a formar, preferencialmente, iões dipositivos (correspondentes à perda dos electrões do subnível s de valência), pois a energia para arrancar um electrão ao último subnível d é muito elevada. Os metais de transição exibem números de oxidação mais elevados nos compostos ou iões que formam com elementos muito electronegativos, como, por exemplo, o ião permanganato – MnO4-. O estado de oxidação mais elevado é +7 e ocorre, exactamente, para o manganês. Agora, já pode compreender-se porque é que o zinco, o cádmio e o mercúrio não são elementos de transição: eles só admitem um número de oxidação, que é igual a +2. Os elementos que têm tendência para formar iões positivos (catiões) em compostos iónicos têm maior carácter metálico. Então, um elemento é tanto mais metálico quanto menor for a sua energia de ionização e a sua afinidade electrónica. Conclusão A Tabela Periódica dos elementos químicos é a disposição sistemática dos elementos, na forma de uma tabela, em função de suas propriedades físicas e químicas. Em que os elementos que apresentam propriedades semelhantes são dispostos em colunas. E o numero atómico crescente disposto em linhas. É muito fácil prever as características e tendências dos átomos. Permite, por exemplo, prever o comportamento de átomos e das moléculas deles formadas, ou entender porque certos átomos são extremamente reactivos enquanto outros são praticamente inertes. Permite prever propriedades como eletronegatividade, raio iónico, energia de ionização. Em 1789 Antoine-Laurent Lavoisier, foi o primeiro a tentar contrui-la, publicando o Tratado Elementar da Química. Construiu uma tabela com 33 substâncias, que as distinguiu de acordo com as analogias verificadas no seu comportamento químico, em metais e não metais. Em 1829, Johoann Döbereiner, organizou as “tríades”, grupo de 3 elementos com propriedades semelhantes e iniciou a noção de grupo. Em 1864, John Newlands agrupou os elementos em sete grupos de sete elementos, por ordem crescente das suas massas atómicas. Propôs a lei das oitavas e iniciou a noção de período. Em 1869, Julius Lothar Meyer construiu uma tabela tomando como base o peso atómico dos elementos. Mostrou a relação entre os volumes atómicos e as massas atómicas relativas - curva de Meyer. Dmitri Ivanovich Mendeleyev substitui o ordenamento pela massa atómica por números atómico. Ele publicou a tabela periódica no seu livro “Princípios da Química” em 1869, época em que eram conhecidos apenas cerca de 60 elementos químicos. Em 1913, através do trabalho do físico inglês Henry G. J. Moseley, que mediu as frequências das linhas espectrais específicas de raios X e de número de 40 elementos contra a carga do núcleo (Z), pôde-se identificar algumas modificações na ordem correcta da tabela periódica, sendo, portanto, o primeiro dos trabalhos experimentais a ratificar o modelo atómico de Bohr. O trabalho de Moseley serviu para resolver um erro em que a Química se encontrava na época por desconhecimento: até então os elementos eram ordenados pela massa atómica e não pelo número atómico. A Tabela Periódica actual é formada por 118 elementos distribuídos em 7 linhas horizontais, cada uma sendo chamada de período. Os elementos pertencentes ao mesmo período possuem o mesmo número de camadas de electrões. Podemos então, concluir que: . O nome "Tabela Periódica" deve-se à periodicidade, ou seja, à repetição de propriedades, de intervalos em intervalos; . A Tabela Periódica não foi simplesmente inventada, mas foi criada a partir de poucos elementos e da sua investigação, a partir daí foi sendo cada vez mais aperfeiçoada e completada com elementos que eram descobertos, e comparados aos que já existiam. Conclui-se que: . Os átomos dos elementos metálicos têm Electronegatividade mais baixas do que os dos não-metais, sendo o flúor o mais electronegativo de todos; . Os elementos que têm tendência para formar iões positivos (catiões) em compostos iónicos têm maior carácter metálico. Então, um elemento é tanto mais metálico quanto menor for a sua energia de ionização e a sua afinidade electrónica; . A afinidade electrónica varia na mesma razão da energia de ionização (se é mais difícil arrancar um electrão a um átomo, é porque ele facilmente capta electrões) e na razão inversa do raio atómico. Bibliografia Nome do Website: Wikipédia Data da última modificação do Website: 17 de Novembro de 2009 Titulo do Artigo: Organização da Tabela Periódica Consultado em: 22 de Novembro de 2009 No Website: http://pt.wikipedia.org/wiki/Tabela_peri%C3%B3dica Nome do Website: Wikipédia Data da última modificação do Website: 7 de Novembro de 2009 Titulo do Artigo: Dmitri Mendeleev Consultado em: 22 de Novembro de 2009 No Website: http://pt.wikipedia.org/wiki/Dmitri_Mendeleiev Nome do Website: Química Total Data da última modificação do Website: Titulo do Artigo: Química Total – Breve História Consultado em: 21 de Novembro de 2009 No Website: http://profmarialuiza.vilabol.uol.com.br Nome do Website: Nautilus Fisica Data da última modificação do Website: Titulo do Artigo: Capitulo_02 Consultado em: 26 de Novembro de 2009 No Website: http://nautilus.fis.uc.pt/cec/teses/flora/docs/capitulo_02.pdf Nome do Website: 1000-Conteudos Educativos1000-Conteudos Educativos Titulo do Artigo: Breve história da tabela periódica Consultado em: 26 de Novembro de 2009 No Website: http://www.esec-valenca.rcts.pt/folha_039.htm Outros Trabalhos Relacionados
|
|