Evolução do Modelo Atómico Sempre que não temos possibilidade de ver algo, mas sabemos que existe, tentamos imaginar como será. Assim acontece com os átomos. Os cientistas foram criando imagens dos átomos baseadas nas observações das experiências que iam realizando. Essas imagens mudaram ao longo dos tempos. Modelo Atómico de Dalton Durante muitos séculos pensou-se que os átomos eram esferas indivisíveis e indestrutíveis.
No inicio do século XIX (1808), o cientista John Dalton, ainda imaginava os átomos assim: corpúsculos indivisíveis e indestrutíveis. A teoria atómica de Dalton pode condensar-se nos seguintes princípios: . a matéria é formada por partículas extremamente pequenas chamadas átomos; . os átomos são esferas maciças, indestrutíveis e indivisíveis; . átomos que apresentam mesmas propriedades (tamanho, massa e forma) constituem um elemento químico; . átomos de elementos diferentes possuem propriedades diferentes; . os átomos podem se unir entre si formando "átomos compostos”. Uma reacção química nada mais é do que a união e separação de átomos; . o seu modelo ficou conhecido como o modelo da “bola de bilhar”. . embora fundada em alguns princípios incertos, a teoria atómica de Dalton, por sua extraordinária concepção, revolucionou a química moderna. . esta ideia de átomo indivisível permaneceu até ao fim do século XIX.  Modelo Atómico de Thomson Nos finais do século XIX experiências realizadas com tubos de descarga revolucionaram o mundo científico. Quando nos terminais de um tubo de descarga, com um gás rarefeito no seu interior, se estabelecia uma grande diferença de potencial, observava-se no seu interior uma fluorescência esverdeada que é independente da natureza do gás e do metal que formava os eléctrodos. O físico Joseph Thomson, explicou que esta fluorescência resultava de partículas com carga eléctrica negativa provenientes do cátodo que chocavam com o vidro. Estas partículas foram designadas por electrões. Isto levou-o a imaginar que os átomos eram corpúsculos de carga positiva onde se encontravam dispersos os electrões, com carga negativa, em número suficiente para a carga global ser nula. Surgiu, assim, o primeiro modelo de átomo divisível. Modelo Atómico de Rutherford No inicio do século XX, o cientista neozelandês Ernest Rutherford realizou a experiência que permitiu imaginar melhor os átomos por dentro. Bombardeou com partículas α uma delgada lâmina de outro (tendo cerca de 10.000 átomos de espessura) e observou com surpresa que: · as partículas α, na sua maioria, atravessaram a lâmina de ouro sem sofrer desvio; · partículas α, em número muito menor eram desviadas, chegando mesmo a voltar para trás.   Estas observações permitiram-lhe concluir que: · a maior parte do átomo seria espaço vazio, por isso, muitas partícula α atravessavam a lâmina sem se desviarem; · no interior do átomo, haveria uma zona central muito pequena, com carga positiva, onde estaria concentrada toda a sua massa. Assim, quando as partículas α, positivas, passavam próxima da zona central positiva do átomo, eram desviadas devida repulsão. Se chocavam frontalmente com ela, voltavam mesmo para trás. Isto levou Rutherford, a imaginar os átomos constituídos por: · um núcleo muito pequeno, com carga positiva onde se concentra toda a massa do átomo; · Electrões com carga negativa movendo-se em volta do núcleo, tal como os planetas se movem em volta do sol. Surgiu assim, por volta de 1910, o primeiro modelo planetário do átomo. 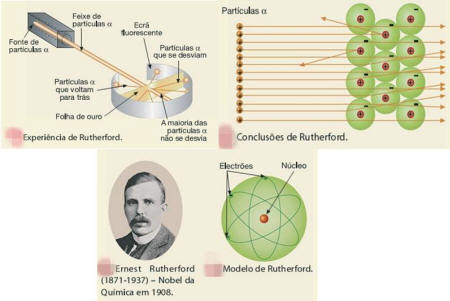 Modelo Atómico de Bohr Em 1913, Niels Borh, completou o modelo de Rutherford com as seguintes ideias: · Os electrões movem-se à volta do núcleo em orbitas circulares; · A cada órbita corresponde um determinado valor de energia; Os electrões com mais energia movem-se em órbitas mais afastadas do núcleo e os que têm menos energia movem-se em órbitas mais próximas do núcleo. 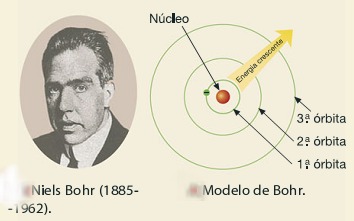 Modelo de Nuvem Electrónica Actualmente está posta de parte a ideia de órbitas circulares para os electrões. Os electrões dos átomos movem-se de modo desconhecido com velocidade elevadíssima, formando uma espécie de nuvem que não é uniforme: a Nuvem Electrónica. A Nuvem Electrónica é mais densa próxima do núcleo, onde é mais provável encontrar os electrões e menos densa longe do núcleo, onde é menos provável encontrar os electrões. O modelo atómico actual é o modelo da nuvem electrónica 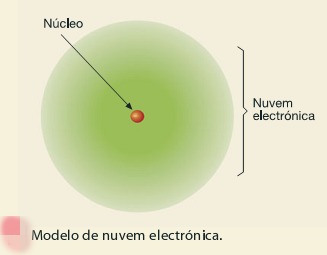 __________________________________ Outros Trabalhos Relacionados | | Ainda não existem outros trabalhos relacionados | |