|
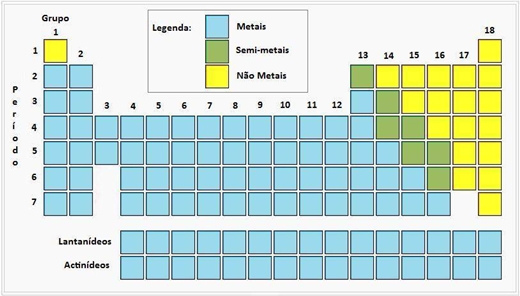
Objectivos: . Verificar se os metais alcalinos são bons condutores da corrente eléctrica; . Observar e comparar a reactividade dos metais alcalinos e dos metais alcalino-terrosos com a água; Introdução: Nos finais do século XIX, os 65 elementos químicos até aí conhecidos foram organizados numa tabela pelo químico russo Mendeleiv. Actualmente, conhecem-se 118 elementos, que estão dispostos na Tabela Periódica actual[1] por ordem crescente de número atómico. Nesta tabela, os elementos formam: Períodos (linhas horizontais) e grupos (colunas verticais). Há 7 períodos, sendo o primeiro constituído por apenas dois elementos. Há elementos metálicos, semi-metálicos e não metálicos[2]. Há 18 grupos, sendo estes constituídos por elementos com propriedades químicas semelhantes. Os elementos que vamos utilizar nesta actividade experimental são do grupo 1 e grupo 2. Grupo 1: Os mais comuns são o lítio, o sódio e o potássio, estes são substâncias elementares designadas por metais alcalinos. Têm propriedades químicas semelhantes: são moles e maleáveis, têm brilho metálico, são bons condutores eléctricos e reagem ás reacções químicas de modo semelhantes. Grupo 2: O magnésio e o cálcio são substâncias elementares designadas por metais alcalino-terrosos. Tal como os do grupo 1, estes também apresentem propriedades semelhantes entre si: são moles e maleáveis, conduzem bem o calor e a electricidade e reagem com a água, embora mais lentamente que os metais alcalinos. Materiais: . Pilha; . Crocodilo; . Suporte e lâmpada; . Potássio (19K) e Sódio (11Na);[3] . Magnésio (12Mg) e Cálcio (20 Ca);[4] . Solução alcoólica de fenolftaleína; . lixa; . Espátulas; . Suporte em vidro (caixa de petri); Procedimento: 1ª Parte da Actividade: . Lixar o magnésio; . Ligar os 2 crocodilos á tira ou “fita” de magnésio; . Realizar o procedimento anterior nos restantes 3 elementos químicos (cálcio, sódio e potássio); 2ª Parte da Actividade: . Colocar uma pequena fita de magnésio sobre a água que contem pequenas gotas de fenolftaleína; . Realizar o mesmo procedimento com os restantes 3 elementos (sódio, potássio e cálcio) Observações: 1ª Parte da Actividade: Pude verificar que tanto os metais alcalino-terrosos como os metais alcalinos são bons condutores de electricidade, pois ao liga-los, a lâmpada acendeu.[5] 2ª Parte da Actividade: Ao colocar o magnésio sobre a água, pude verificar a formação de bolhas gasosas. Ao repetir o mesmo procedimento com o cálcio, reparei que a reacção deste foi muito mais rápida do que a do magnésio. Desta vez com os metais alcalinos: ao cortar, verifiquei que ambos apresentavam um brilho metálico, verifiquei também que como os alcalino terrosos, também reagem com a água, só que muito mais rápido. Com o sódio, ao contactar com a água, o metal rodopiou, e ouviu-se um ruído. O mesmo acontece com o potássio, mas de modo muito mais rápido havendo uma chama na reacção. Em ambas as experiencias (tanto de alcalinos como de alcalino-terrosos), a fenolftaleína tornou-se carmim. Equações: As reacções dos metais alcalinos com a água, podem ser traduzidas pelas seguintes equações químicas: 2Na (s) + 2H2O (l) → 2NaHO (aq) + H2 (g) Sódio (s) + água (l) → Hidróxido de sódio (aq) + di-hidrogénio 2K (s) + 2H2O (l) → 2KHO (aq) + H2 (g) Potássio (s) + água (l) → Hidróxido de potássio (aq) + di-hidrogénio As reacções dos metais alcalino-terrosos com a água, podem ser traduzidas pelas seguintes equações químicas: Mg (s) + 2H2O (l) → 2Mg(HO)2 (aq) + H2 (g) Magnésio (s) + água (l) → Hidróxido de magnésio (aq) + di-hidrogénio Ca (s) + 2H2O (l) → 2Ca(HO)2 (aq) + H2 (g) Cálcio (s) + água (l) → Hidróxido de cálcio (aq) + di-hidrogénio Conclusão: Com a realização da primeira parte da experiencia posso concluir que tanto os metais alcalinos como os metais alcalino terrosos são bons condutores eléctricos, dado que a lâmpada acendeu. Na segunda parte posso concluir que o sódio e o potássio (metais alcalinos) apresentam propriedades químicas idênticas: são moles e maleáveis, têm um brilho metálico como pude observar quando os cortamos na realização da experiencia e reagem de modo com a água de modo semelhante, no entanto a reacção do potássio é mais rápida e a do sódio mais lenta. Com isto posso concluir que a reactividade dos metais alcalinos é diferente, isto deve-se ao facto de átomos como o sódio, de menor tamanho que os de potássio, perdem o electrão de valência com menos facilidade, transformando-se assim menos facilmente em ião positivo, ou seja, menos reactivo. O mesmo aconteceu com o magnésio e o potássio, sendo o cálcio o mais reactivo pela razão de ser o átomo de maior tamanho, perde os dois electrões de valência com mais facilidade, transformando-se assim mais facilmente em ião positivo pelo qual é mais reactivo. Anexo 1:
Anexo 2:
Anexo 3:
11Na 19K Anexo 4:
12Mg 20Ca Anexo 5:
Sódio Outros Trabalhos Relacionados
|
|