|
Objectivos Os objectivos da realização desta actividade experimental foram a aprendizagem da determinação e comparação dos valores obtidos no ponto de fusão e ebulição de diversas substancias, a determinação da densidade de alguns materiais utilizando vários métodos, a utilização de picnómetros e densímetros e também uso do equipamento automático e tradicional. Teve ainda como objectivos a interpretação de representações gráficas de variação de temperatura em função do tempo, comparação de valores de densidade obtidos com valores tabelados para a determinação de pureza dos mesmos e, por fim, a determinação de pontos de ebulição e fusão de diversos materiais através de diversos métodos. Introdução Introdução Teórica A densidade, a temperatura de fusão, temperatura de ebulição, etc, são chamadas constantes físicas e permitem identificar e reconhecer cada substância por entre outras. Cada substância é caracterizada por este conjunto de propriedades físicas e químicas. Os materiais que se encontram na Natureza, não são normalmente, substâncias puras, mas sim misturas de substâncias. Mesmo as substâncias ditas puras têm uma determinada percentagem de impurezas, que determinam o grau de pureza de uma amostra. A determinação das constantes físicas de uma amostra de substância poderá, pois, servir para identificar essa substância e avaliar o seu grau de pureza. A densidade ou massa volúmica de uma substância é a massa existente em casa unidade de volume dessa substância. Representa-se pela letra grega ρ (lê-se ró), e o seu valor obtém-se pelo quociente entre a massa de uma amostra da substância em estudo e o seu respectivo volume. A densidade resolve-se pela seguinte fórmula: ρ= m/V Mudanças de estado originam mudanças na densidade de uma dada substância, o que nos permite afirmar que a densidade de um mesmo material depende da temperatura. A unidade SI de densidade é o Kg m-1. Usualmente, as densidades de sólidos e de líquidos exprimem-se em unidades diferentes da unidade SI, que são: g cm- e Kg dm-. Se considerarmos uma unidade de volume, a densidade relativa passa a ser expressa através das razões entre as densidades da substância em estudo e da substância de referência. d= ρsubstância/ρsubstância de referência Por vezes usa-se uma outra grandeza física, que nos é dada pelo quociente entre a massa de um dado volume da substância em estudo e a massa de igual volume de uma substância tomada como ponto de referência. Chama-se a densidade relativa (d). d= msubstância/msubstância de referência Geralmente, a substância usada como termo de comparação para sólidos e líquidos é a água pura, a 4ºC a sua densidade é 1 g cm-.
Há vários processos para a determinação da massa volúmica e a densidade relativa de uma substância. Para substâncias sólidas pode recorrer-se à técnica do picnómetro ou então, à medição do volume e massa a amostra sólida e, a partir daí, calcular a sua densidade através da fórmula atrás referida. Para líquidos, ou se mede directamente a sua densidade usando um densímetro ou se recorre também à técnica do picnómetro. Os picnómetros são frascos de vidro de pequena capacidade com forma ligeiramente diferente, consoante se pretenda determinar a densidade de um sólido não solúvel em água ou de um líquido. Os densímetros são aparelhos flutuantes graduados que dão por leitura directa, a densidade do líquido em que flutuam.
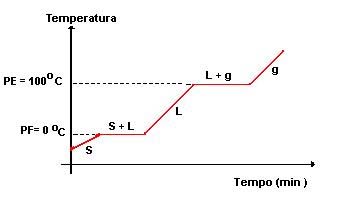
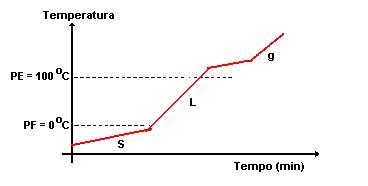
Quando aquecida uma amostra sólida, esta atinge uma determinada temperatura, passando ao estado liquido. A essa temperatura dá-se o nome de ponto de fusão, ou temperatura de fusão. Se a amostra for totalmente pura começa a fundir a uma dada temperatura mantendo-se nela até durar a fusão da amostra. Se pelo contrário, a amostra não for pura irá ocorrer uma variação dessa mesma temperatura – não será constante – variação essa tanto maior quanto menor for o grau de pureza da amostra
§ O ponto de fusão depende da pressão exterior. O mesmo acontece se aquecermos uma substância no estado líquido, ela entra em ebulição a uma dada temperatura, chamada temperatura de ebulição ou ponto de ebulição, também característico dessa substância. Na ebulição de uma substância pura, a temperatura manter-se-á constante. Pelo contrário, se durante a ebulição da amostra a analisar a temperatura variar, essa amostra é uma substância impura. § A temperatura de ebulição de um líquido depende, também, da pressão exterior. § Só quando a pressão de vapor do líquido igualar a pressão exterior é que este entra em ebulição. Parte Experimental Materiais e Reagentes Método indirecto de determinação da densidade de um sólido usando a proveta Ø Amostra de um sólido insolúvel Ø Balança Ø Proveta Ø Esguicho com água destilada Método indirecto de determinação da densidade de um sólido usando o picnómetro de sólidos Ø Amostra de sólido insolúvel Ø Balança Ø Picnómetro de sólidos Ø Papel absorvente Ø Esguicho de água ionizada Método indirecto da determinação da densidade usando o picnómetro de líquidos Ø Amostra de líquido Ø Água Ø Balança Ø Picnómetro de líquidos Método directo da determinação da densidade de um liquido usando o densímetro Ø Densímetro Ø Líquido em estudo Ø Proveta Técnica de determinação do ponto de fusão usando equipamento tradicional Ø Densímetro Ø Líquido em estudo Ø Proveta Ø Amostra em estudo Ø Tubo capilar com 1 a 2 mm de diâmetro aberto numa das extremidades Ø Vidro de Relógio Ø Termómetro Ø Copo de precipitação Ø Fonte de Aquecimento Ø Elástico Ø Suporte Ø Vareta Aberta Técnica de determinação do ponto de ebulição de um líquido usando o equipamento tradicional Ø Líquido e ensaiar Ø Placa eléctrica Ø Termómetro Ø Copo de precipitação Modo de proceder Método indirecto de determinação da densidade de um sólido usando a proveta Ø Medimos a massa m do corpo. Ø De seguida, medimos o volume V do corpo por deslocamento de água. Ø Calculámos a densidade da amostra (ρ= m/V). Método indirecto de determinação da densidade de um sólido usando o picnómetro de sólidos Ø Medimos a massa m da amostra sólida e registámos o seu valor. Ø Enchemos o picnómetro com água destilada (evitando a formação de bolhas de ar). Ø Depois, medimos a massa M, do picnómetro cheio de água, com o sólido ao lado. Registámos o valor obtido. Ø Introduzimos a amostra sólida dentro no picnómetro. Ø Limpámos o picnómetro com papel absorvente. Ø Medimos a massa M’ do picnómetro com água e o sólido. Ø Calculámos a massa m’ da água deslocada pelo sólido (m’= M-M’) Ø Por último, calculámos a densidade relativa do corpo (d = m/m’). Método indirecto da determinação da densidade usando o picnómetro de líquidos Ø Medimos a massa m do picnómetro vazio e registámos o seu valor. Ø Enchemos o picnómetro o líquido em estudo. Ø Medimos a massa M do picnómetro cheio de líquido e registámos o valor obtido. Ø Enchemos o picnómetro com água destilada e registámos o valor da massa M’ deste. Ø De seguida, calculámos a densidade relativa do líquido (ρ=M-m/M’-m). Método directo da determinação da densidade de um liquido usando o densímetro Ø Colocámos numa proveta o líquido em estudo. Ø Colocámos o densímetro para que a sua base não tocasse no fundo da proveta. Ø Lemos no densímetro o valor da densidade (na superfície de afloramento) e registámos o valor. Técnica de determinação do ponto de fusão usando equipamento tradicional Ø Colocámos o sólido em pó num vidro de relógio Ø Mergulhámos a extremidade aberta do tubo capilar na amostra, de modo a que algum sólido entrasse no tubo. Ø Invertemos o tubo capilar e fizemo-lo descer através da vareta aberta para que o pó caísse com mais facilidade. Ø Repetimos a operação até que o tubo capilar ficasse com cerca de 1 cm de altura de sólido. Ø De seguida, fixámos o tubo capilar a um termómetro com um elástico. Ø Colocámos o conjunto num copo de precipitação, num banho com água. Ø Depois, aquecemos moderadamente o banho. Ø Assim que a amostra fundiu totalmente registámos o valor da temperatura. Técnica de determinação do ponto de ebulição de um líquido usando equipamento tradicional Ø Colocámos o líquido em estudo dentro de um copo de precipitação. Ø De seguida, colocámos o copo de precipitação sobre a placa de aquecimento e, dentro deste, pusemos um termómetro seguro por um suporte. Ø Observámos a temperatura a subir e registámos o seu valor no ponto de ebulição do líquido. Cuidados de segurança . Usar sempre bata de algodão (de preferência que se aperte à frente, para ser mais fácil de despir no caso de acidente com reagentes). . Prender os cabelos compridos. . Não fumar, comer, beber ou guardar alimentos no Laboratório. . Nunca provar ou cheirar directamente os produtos químicos. . Não brincar ou correr no laboratório. . Não realizar experimentos sem o conhecimento do docente. . Executar o protocolo com rigor. . Não pipetar com a boca, utilizar a pipeta com a pompete. . Não manusear os reagentes directamente com as mãos. . Não colocar ao pé de qualquer chama substâncias inflamáveis. . Não manusear equipamento eléctrico com as mãos húmidas. . Colocar o material de vidro partido ou rachado em recipientes próprios. . Nunca apontar o tubo de ensaio para si mesmo ou para um colega. . Caso se parta algum material, avisar imediatamente o professor, e não fingir que não aconteceu nada, para evitar acidentes. . Nunca voltar a pôr no frasco reagente que dele tenha sido retirado, pois pode levar impurezas e adulterar o conteúdo . Eliminar os restos de substâncias utilizadas. . Tentar ter os tubos de ensaio sempre num suporte, não só pela segurança mas também pela higiene. . Deixar sempre a bancada limpa e arrumada, todas as torneiras fechadas e os aparelhos eléctricos desligados. Registo de observações Técnica de Determinação Indirecta da Densidade de um Sólido Insolúvel Após as medições da massa e volume da substância, verificámos que a substância tem como valor de densidade 7,6 g/cm3. Técnica da Determinação da Densidade de um Sólido Insolúvel usando um Picnómetro Após a medição da massa da amostra sólida, do picnómetro cheio de água e destas juntas calculámos o valor da densidade, que é 4,2 g/cm3. Técnica da Determinação da Densidade de um Líquido usando o Picnómetro Neste método, verificámos que ao subtrair a massa do picnómetro com líquido pela massa do picnómetro vazio e ao subtrair a massa do picnómetro com água pela massa do picnómetro vazio e em seguida dividir amos os valores, obtemos a densidade relativa da substancia, que é 0,85 g/cm3. Técnica de Determinação da Densidade de um líquido usando o Densímetro Verificámos que o líquido em estudo tem densidade no valor de 0,8 g/cm3, após executarmos esta actividade. Técnica da Determinação do ponto de Fusão usando equipamento tradicional Ao colocarmos os tubos capilares no aparelho com conferimos que o Pó Branco ao atingir uma temperatura de aproximadamente 80ºC – 82ºC, atingiu o seu ponto de fusão. Técnica de Determinação do Ponto de Ebulição de um líquido usando equipamento tradicional Ao colocarmos o liquido dentro do copo de precipitação e ao deixar o mesmo sobre a placa de aquecimento, verificámos que este atingiu o seu ponto de ebulição aos 76 e 78 ºC. Cálculos Técnica de Determinação Indirecta da Densidade de um Sólido Insolúvel m = 0,76g Volume do corpo = Vf – Vi = 11 – 10 = 1 ml r = m / V = 0,76g / 0,1 ml = 7,6 g/cm3 Técnica da Determinação da Densidade de um Sólido Insolúvel usando um Picnómetro m = 0,76g M = 87,88g M’ = 87,65g m’ = M – M’ = 153,96g – 153,78g = 0,18g d = m / m’ = 0,76 / 0,18 = 4,2 g/cm3 Técnica da Determinação da Densidade de um Líquido usando o Picnómetro m = 28,03g M = 68,51g M’ = 78,41g r = (M - m) / (M’ – m) = (68,51 – 28,03) / (78,41 – 28,03) = 0,85 g/cm3 d = r / r’ = (0,81 g/cm3) / (1,00) = 0,81 Técnica de Determinação da Densidade de um líquido usando o Densímetro Densidade do líquido em estudo: 0,8 g/cm3 Técnica da Determinação do ponto de Fusão usando equipamento tradicional Ponto de Fusão da Substância sólida = 82 ºC. Técnica de Determinação do Ponto de Ebulição de um líquido usando equipamento tradicional Ponto de Ebulição do Primeiro Líquido = 78 ºC. Análise de Resultados Método indirecto de determinação da densidade de um sólido usando a proveta e Método indirecto de determinação da densidade de um sólido usando o picnómetro de sólidos Nestas duas experiências, podemos verificar, que apesar de terem ocorrido alguns erros nos resultados obtidos, observámos a tabela de densidades e pudemos verificar que a substância em estudo que possui o valor mais aproximado é o Zinco. Técnica da Determinação da Densidade de um Líquido usando o Picnómetro e Técnica de Determinação da Densidade de um líquido usando o Densímetro Em ambas as técnicas realizadas foi utilizado a mesma substância líquida e, ao contrário do caso anterior, não houve exactidão de resultados mas ocorreu uma maior precisão. Após a observação da tabela verificámos que a amostra líquida era o Etanol. Técnica da Determinação do ponto de Fusão usando equipamento tradicional Foi usada uma substância branca, e após obtermos o resultado do seu ponto de fusão, fomos observar na tabela de temperaturas de fusão, e chegamos à conclusão que a substancia era o Naftaleno. Técnica de Determinação do Ponto de Ebulição de um líquido usando equipamento tradicional Nesta última experiência, tal como na anterior, forma comparados os valores obtidos com os valores apresentados nas tabelas a concluímos que a substância estudada se tratavam do Etanol. Conclusão Com esta actividade laboratorial concluímos que devido ao facto de cada substância ter os seus próprios valores de densidade, densidade relativa, ponto de ebulição e ponto de fusão, podemos identificar uma substância desconhecida. Durante esta actividade, houveram algumas dificuldades pois alguns dos resultados obtidos tiveram erros que nos fizeram ter mais dificuldade na identificação das substâncias. Muitos desses erros foram devido ao material, mas também devido às amostras estudadas não serem substâncias puras. Ficha de Controlo 1. ( A ) V ( B ) F ( C ) V ( D ) V 2. 2.1 0,01 2.2 V= 2 = 8cm 2.3 ρ = m / V = 96,01 g / 8 cm3 = 12,00125 g / cm3 2.4 d = 12,0 g/cm3 / 1,00 g/cm3 d= 12,0 3. a) e b) V= 67-52,5= 14,5 cm m= 30,4g ρ= 30,4/14,5 = 2,09655 g/cm c) V= 0,145 m m= 0,0304 Kg ρ= 0,0304/0,145= 0,20966 Kg/m 4. d= (105,52- 41,53)/50 = 1,2798 g/cm 5. (D) 6. 6.1 É uma substância porque durante a fusão não se observou uma variação de temperatura superior a 1ºC. 6.2 ( A ) 20ºC ( B ) 20ºC a 40ºC ( C ) 20ºC 7. ( A ) 8. 8.1 É uma substância porque durante a fusão não se observou uma variação de temperatura superior a 1ºC. 8.2 (80,0+80,1+80,2+80,3)/4 =80,2ºC 8.3 Naftaleno 9. 9.1 Ponto de Ebulição 9.2 A temperatura de ebulição iria aumentar. 9.2 ( A ) Bibliografia Internet http://nautilus.fis.uc.pt/spf/DTE/pdfs/fisica_quimica_a_10_homol_nova_ver.pdf http://images.google.pt/images?gbv=2&hl=pt-BR&sa=3&q=copos+de+precipita%C3%A7%C3%A3o&btnG=Pesquisar+imagens http://images.google.pt/images?hl=pt-BR&source=hp&q=picnometros&btnG=Pesquisar+imagens&gbv=2&aq=f&oq= http://images.google.pt/images?gbv=2&hl=pt-BR&sa=1&q=tubos+capilares&btnG=Pesquisar&aq=f&oq=&start=0 Livros DANTAS, Maria da Conceição ; RAMALHO, Marta Duarte – Jogo das partículas A: caderno de actividades laboratoriais. Lisboa: Texto Editora, 2007
Outros Trabalhos Relacionados
|
|
||||||||||||||||||||||||||||||||