|
Introdução/Fundamentos teóricos Este relatório é sobre o trabalho laboratorial que tem como objectivo determinar o ponto de fusão da substância naftaleno () , o ponto de fusão era o que estávamos a espera (80º-82º), e através desde processo ficamos a saber o grau de pureza da substancia em analise. Este trabalho laboratorial foi realizado em três aulas devido a ter corrido mal as anteriores. Para realização deste trabalho laboratorial consultou-se o protocolo do Caderno de Actividades Laboratoriais de Química referente à “Técnica de determinação do ponto de fusão usando equipamento tradicional”. Objectivos . Determinar o ponto de fusão da substância em análise (naftaleno). . Avaliar o grau de pureza da substancia em análise. Informações Naftaleno Naftaleno em pó . Formula química: . Cálculo da massa molecular: M ()=10 × A(C) + 8 × A(H) = =10 × 12 + 8 × 1= =120+8 = 128 g/mol . Sólido inflamável . Ponto de fusão = (80 ± 0.05) º C . Ponto de ebulição = 217.7 ºC Riscos: R 10-Inflamavel. R 25-Toxico por inalação, por ingestão e em contacto com a pele.
Segurança: S 15- Manter afastado do calor. S 16- Conservar afastado de qualquer chama ou fonte de ignição. S 46-Em caso de ingestão, consultar imediatamente um médico e mostrar-lhe a embalagem ou rótulo.
Procedimento A. Enchimento do tubo capilar 1. Colocar o sólido (em pó), num vidro de relógio. 2. Mergulhar a extremidade aberta do tubo capilar na amostra, de modo a que algum sólido entre no tubo. 3. Inverter o tubo capilar de modo a que o pó desça até à extremidade fechada do tubo. 4. Repetir a operação até que o tubo capilar fique com cerca de 1 cm de altura de sólido. B. Montagem 1. Fixar o tubo capilar a um termómetro com um elástico. 2. Colocar o conjunto num copo ou num tubo de Thiele com um banho apropriado (água, caso a amostra funda a uma temperatura inferior a 100 ºC, ou glicerina, óleo ou parafina líquida, caso a amostra funda a uma temperatura superior a 100 ºC). C. Determinação do ponto de fusão 1. Aquecer moderadamente o banho e registar o valor da temperatura e estado físico da amostra, à medida que a temperatura vai subindo. 2. Logo que a amostra tenha fundido na totalidade (a amostra fica transparente), suspender o aquecimento e deixar que o banho arrefeça até cerca de 20 ºC. 3. Realizar pelo menos três ensaios.
Tratamento de Resultados
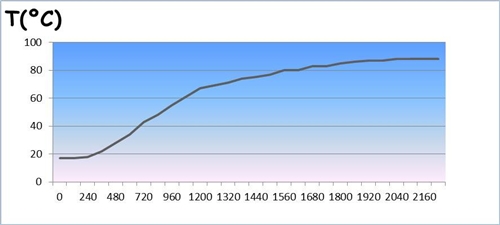
Através dos dados obtidos na tabela anterior, construiu-se o seguinte gráfico:
Variação Temperatura – Tempo do naftaleno . Observa-se um patamar no gráfico anterior correspondente a passagem da substância do estado sólido para líquido, apesar de ser pouco visível, contudo devia-se ter observado o seguinte gráfico, considerando que a substância é pura:
. Trata-se de uma transformação física porque a substancia muda de estado física (passa de sólido para liquido) Análise e interpretação dos resultados . O patamar existente no gráfico é quando a substancia esta a mudar de estado físico (sólido – liquido) e assim a energia de aquecimento é utilizada para quebrar as ligações das moléculas (energia inter-molecular) da substância em análise, isso explica a temperatura manter-se constante e o tempo continuar a aumentar durante o patamar. Assim que a substancia ficar totalmente líquida a temperatura começa de novo a aumentar. . Na medição do ponto de fusão de uma amostra que se julga pura não se deve observar, durante a fusão, uma variação de temperatura superior a 1 ºC, se a amostra não for pura irá ocorrer uma variação essa tanto maior quanto menor for o grau de pureza da amostra. . Cada substância é caracterizada por um conjunto de propriedades físicas e químicas, como a densidade, a temperatura de fusão, a temperatura de ebulição etc. . Essas propriedades são também chamadas constantes físicas e permitem, no seu conjunto, reconhecer e identificar cada substancia, funcionado como o sei “bilhete de identidade”. . A maior parte das substâncias existentes na Natureza são substâncias puras, mas as misturas de substâncias podem ser separadas por diferentes processos químicos. Mas mesmo as substancias puras têm sempre uma determinada percentagem de impurezas, que determinam o grau de pureza d uma amostra. . O ponto de fusão depende da pressão exterior. Material . Vidro de relógio . Tubo capilar . Suporte universal . Gobelé . Cronometro . Elástico . Amostra em estudo (naftaleno) . Placa de aquecimento . Tubo de Thiele/ tubo de ensaio . Nos . Garras . Água . Termómetro analógico 10ºC - 110ºC Erro ou incerteza: ± 0.05 ºC Conclusão Concluiu-se então que a amostra analisada (naftaleno) é uma substância pura porque não ocorreu uma variação da temperatura significativa (superior a 1 ºC) durante a fusão, variação essa tanto maior quanto menor for o grau de pureza da amostra. Observações Alem das duas aulas laboratoriais, realizou-se mais uma tentativas devido as anteriores terem corrido mal devido a na primeira tentativa de tentar determinar o ponto de fusão, já a placa de aquecimento estava a uma temperatura elevada e assim não teve-se valores suficientes na tabela para construir o gráfico, e na segunda tentativa ter-se posto pouca água no gobelé e assim o calor não chegava ao tubo capilar que continha o naftaleno, e a temperatura (ainda o naftaleno não ter atingido o ponto de fusão) começõu a diminuir. Bibliografia Livro: . DANTAS, Maria da Conceição et alii (2007), Jogo de Partículas A (caderno de actividades laboratoriais), Lisboa, Texto Editores Outros Trabalhos Relacionados
|
|