|
Objectivo do trabalho O objectivo da experiência que realizamos foi a determinação do ponto de fusão do naftaleno e do ponto de ebulição da água destilada, do álccol etílico e da acetona. Para em seguida compararmos os valores obtidos com os tabelados. Introdução Na seguinte experiência determinaremos o ponto de fusão de Naftaleno usando a técnica tradicional. Em seguida, determinaremos o ponto de ebulição da água destilada, da acetona e do álccol etílico. O ponto de fusão designa a temperatura a que uma dada substância passa do estado sólido para o estado líquido, esta temperatura é constante (se a pressão for constante), por isso podemos calcular a pureza de uma substância através do seu ponto de fusão. Se houver uma variação no ponto de fusão, de uma substância, inferior a 1ºC, essa variação não é considerada. O ponto de ebulição designa a temperatura a que uma dada substância passa do estado líquido para o estado gasoso. Numa substância pura, a variação do seu ponto de ebulição nunca é superior a 1ºC, caso contrário a substância não seria pura (tal como no ponto de fusão).
Na figura ao lado, é observável a relação de temperatura e tempo dos pontos de ebulição (PE) e dos pontos de fusão (PF).
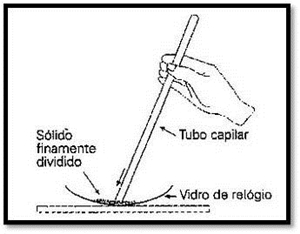
Na técnica tradicional para determinar o ponto de ebulição, é usado um termómetro, no qual se prende o capilar (com o Naftaleno). Esse termómetro é mergulhado em água. Na determinação do ponto de fusão do Naftaleno, teremos que introduzir num capilar o Naftaleno em pó. Isto deve ser feito do seguinte modo:
Primeiramente, deve fazer-se tal como nos indica a figura à esquerda. Em seguida, devemos colocar o capilar (voltado para cima) num tubo de vidro e deixá-lo cair (repetindo até que o
Determinação do ponto de fusão do Naftaleno Material . Almofariz com mão; . Gobelé de 100 ml; . Placa de aquecimento; . Tubos capilares (2); . Termómetro; . Vidro de relógio; . Suporte universal; . Espátula; . Tubo de vidro; . Vareta de vidro. Reagentes . Naftaleno; . Água da torneira. Procedimento
1. Reduzir a pó o
Naftaleno, num almofariz de mão.
Esquerda – a desfazer o Naftaleno.
Direita – Naftaleno em pó.
2. Introduzir o Naftaleno
num capilar (como descrito na introdução). A altura do pó no capilar,
deve ser de cerca de 1 cm.
Tubo capilar com
Naftaleno em pó. 3. Juntar o tubo capilar ao termómetro, usando um elástico. 4. Colocar o tubo capilar e o termómetro num suporte universal. 5. Emediatamente abaixo do termómetro, colocar um gobelé com água da torneira (que deve estar em cima de uma placa de aquecimento ligada). 6. Aquecer rapidamente a água e anotar a temperatura observada (o naftaleno tem que passar de um tom branco para transparente). 7. Aquecer novamente o gobelé, mas desta vez, abruptamente até menos 20ºC que a temperatura observada primeiramente. Em seguida, reduzir a temperatura da placa de aquecimento e anotar o novo valor observado. 8. Determinámos o valor médio das temperaturas observadas. Esquema de Montagem
Resultados Experimentais
80,2ºC Valor médio dos resultados obtidos
Média dos resultados obtidos = 82ºC Determinação do ponto de ebulição do Álcool Etílico, da Acetona e da Água destilada Material . Gobelés de 100 ml (4); . Máquina medidora do ponto de ebulição; . Esquicho. Reagentes . Acetona; . Álccol Etílico; . Água desionizada. Procedimento 1. Colocámos a acetona num gobelé. 2. Mergulhamos o medidor do ponto de ebulição na acetona e carregámos no botão. 3. Registamos o valor obtido. 4. Carregámos novamente no botão para desligar a máquina e retiramos o medidor. 5. Lavámos o medidor com a substância que iamos usar de seguida. 6. Repetimos todos os passos anteriores para a água desionizada e para o álccol etílico. Esquema de Montagem
Resultados Experimentais
No caso da acetona, um dos valores (250ºC) foi desprezado, por ser demasiado alto, em comparação com os restantes valores.
Análise e discussão crítica dos resultados Ponto de fusão do Naftaleno Nesta experiência, ambos os ensaios deram exactamente a mesma temperatura, devido à precisão do método utilizado. Podemos ainda observar que o valor tabelado para a fusão do Naftaleno é de 80,2ºC e o valor obtido foi de 82ºC , provavelmente a variação de pontos de ebulição deve-se ao facto do Naftaleno não se encontrar no seu estado puro e sim impuro. A variação de tempo que demorou cada ebulição deveu-se ao facto de num dos ensaios (2º) o aquecimento da água ter sido mais lento. Ponto de ebulição da Acetona Na determinação do ponto de ebulição da acetona, um dos valores revelou-se muito distante dos valores seguintes, por isso foi desprezado. Nos restantes ensaios os valores foram próximos. A média dos resultados obtidos revelou-se distante do valor tabelado, talvez pela impureza da substância em estudo ou por falta de precisão da máquina utilizada, ou ainda por erro humano. Ponto de ebulição do Álccol Etílico Nesta experiência, a média dos valores obtidos revelou-se muito próxima do valor tabelado, o que significa que foi relativamente bem calculado e que a substância se encontra num estado de pureza parecido ao do valor estabelecido (91% de álccol etílico). Ponto de ebulição da Água Desionizada Nesta experiência, o valor observado revelou-se superior ao do tabelado pelas mesmas razões que o ponto de ebulição da acetona. Conclusão Observando todos os valores analisados podemos concluir que as substâncias que usamos, provavelmente, não estavam no seu estado mais puro, porque os resultados experimentais mostram-se demasiado diferentes dos tabelados, acontecendo apenas se a substância estivesse realmente impura ou o aparelho/método utilizado não se mostrasse altamente preciso. Webografia http://noseaquimica.blogspot.com/2008/02/relatrio-ponto-de-fuso-ponto-de-ebulio.html Outros Trabalhos Relacionados
|
|