|
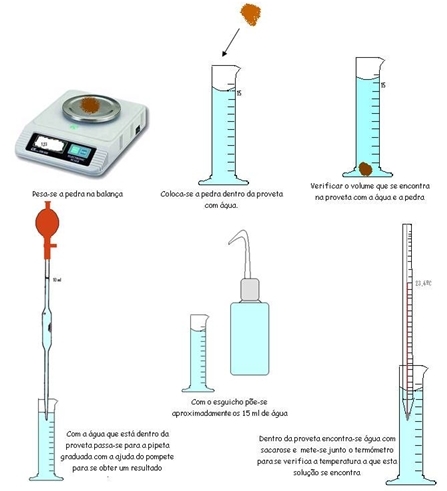
Objectivos: Pesar um sólido irregular e medir o seu volume por deslocamento de água. Preparar uma solução aquosa que contenha cerca de 5g de açúcar em 250ml de solução e medir a respectiva temperatura. De um frasco contendo água, medir: . Rigorosamente 10ml de água; . Aproximadamente 15mL de água; . Rigorosamente 12,2 mL de água; . Rigorosamente 50 mL de água. Introdução teórica: Uma solução é uma mistura de substâncias em que existe um soluto e um solvente. Medir grandezas físicas (Medição e medida, erros na medição, exactidão e precisão da medida, ordem de grandeza de um número, Algarismos significativos e regras para a contagem de algarismos significativos) Medição de massas, volumes e temperaturas usando diversos instrumentos adequados. Material: . Pedra; . Copo de precipitação; . Pompete; . Vareta de vidro; . Espátula; . Garrafa de esguicho com água; . Proveta volumétrica; . Termómetro; . Filtro de papel; . Funil de Vidro; . Balão volumétrico. Equipamento: . Balança. Reagentes: . Água; . Açúcar. Precauções: . Não correr no laboratório; . Não utilizar material sujo; . Após a utilização da balança, deve-se desligá-la primeiro e só depois retirar o material pesado; . Não meter o termómetro directamente na água, mas sim devagar, para que este não se estrague. . Não comer no laboratório; . Não danificar o material. Procedimento: 1ºProblema: . Determinar numa balança de alcance adequado (0.001g) a massa do açúcar calculada. . Colocar água numa proveta (volume = 15 ml) e em seguida colocar a pedra no seu interior para determinar o seu volume ( = 15,45 ml, devido ao deslocamento da água por causa da pedra). Na segunda tentativa com a mesma pedra e a mesma quantidade de água o seu volume foi mais reduzida ( = 15,40 ml) e na terceira voltou da dar o volume da primeira tentativa, ( ou seja, 15,45 ml). Assim concluímos que a meia da massa da pedra é de 0,45 ml. 2ºProblema: . Preparar a solução aquosa com a massa de açúcar pesada ( = 5,00g) juntar água, num copo de precipitação, e em seguida mexer com uma vareta. . Transferir a solução obtida para um balão volumétrico e adicionar água até à medida desejada, depois, agitar bem. 3ºProblema: . Calcular a concentração mássica. . Através de um pompete e de uma pipeta graduada, medir rigorosamente 10ml de água. . Utilizando uma proveta e uma garrafa de esguicho com água mediu-se aproximadamente 15ml de água. . Com uma pipeta graduada, um pompete e uma proveta mediu-se rigorosamente 12,2ml de água. . Com uma pipeta graduada, pompete e uma proveta mediu-se rigorosamente 50ml de água. . Com um termómetro medimos a temperatura da água. Esquema:
Registo de Observações: Pesou-se a pedra na balança de sensibilidade 0,01 e com a mesma tolerância, o resultado obtido foi de 1,23g. Colocou-se a mesma pedra dentro de uma proveta com 15,00 mL de água e o volume da água aumentou e deu-nos a informação de 15,45 mL. Fez-se esta medição três vezes, e obtemos dois resultados diferentes, na segunda tentativa deu-nos 15,40 mL, na terceira deu o mesmo que a primeira tentativa, ou seja, 15,45. No fim foi feita uma média de todos os resultados obtidos, assim, verificamos que o volume da pedra era de 0,43 mL. Na balança pesamos 5,00g de sacarose, e metemo-la dentro de um gobelé, juntamos água e ia-se mexendo com uma vareta de vidro até ficar bem dissolvido. De seguida colocamos o termómetro junto da solução para saber a temperatura a que este se encontra e apuramos que era cerca de 23,4ºC. Num gobelé metemos água, sem ser uma quantia exacta, de seguida retiramos através de uma pipeta volumétrica e com a ajuda de um pompete rigorosamente 10 mL de água e metemos dentro de uma proveta. Com o esguicho de água metemos para dentro de uma outra proveta aproximadamente 15 mL de água. Voltamos a utilizar a pipeta volumétrica e o pompete para retirarmos rigorosamente 12,2 mL de água e 50 mL do mesmo líquido e metemos em outras provetas. Cálculos: Calcular o volume da pedra: 1ª Tentativa: Vpedra=Vfinal-Vinicial Vpedra=15,45-15,00 Vpedra=0,45 mL 2ª Tentativa: Vpedra=Vfinal-Vinicial Vpedra=15,40-15,00 Vpedra=0,40 mL 3ª Tentativa: Vpedra=Vfinal-Vinicial Vpedra=15,45-15,00 Vpedra=0,45 mL MEDIA: 0,45 + 0,40 + 0,45 = 1,3 = O,43 ml 3 3 Calcular a concentração mássica (Cm) da solução de água com sacarose: 1ml = 0,001L 30 x 0,001 = 0,03 L 30ml = x L 1 1 L = 1 dm3 0,03 x 1 = 0,03 dm3 0,03 L = x dm3 1
Cm = Msoluto : Vsolução Cm = 5,00 : 0,03 Cm = 16,67 g/dm3 Tabelas:
Conclusão: O trabalho decorreu normalmente, foram cumpridos todos os objectivos e respeitadas todas as normas laboratoriais. Concluiu-se então, que existem várias formas de medição utilizando diversos materiais e que para medir um volume basta juntar este com a água, numa proveta, por exemplo, e verificar a quantidade que elevou. Bibliografia: . Mendonça, L.; Dantos, M.; Ramalho, M. (2004). Jogo de Partículas. Lisboa: texto editora Outros Trabalhos Relacionados
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||