|
Protocolo Experimental
Objectivos: Preparação de uma solução de sulfato de cobre II (CuSO4) de concentração 0,02 mol dm-3. Diluição da solução, com factor de diluição 2. Introdução: O Sulfato de Cobre II é um composto químico que se representa da seguinte forma: CuSO4. Este também se designa por Sulfato Cúprico. O Sulfato de Cobre II é um sólido azul, e devido a isso, é conhecido como vitríolo azul. Este composto químico apresenta cinco moléculas de água, perdendo quatro destas a temperaturas de 110º/150º, formando assim um composto designado por: anidro branco. O Sulfato de Cobre II utiliza-se em várias aplicações, tais como: na preservação da madeira; na agricultura (como bactericida…); como aditivo em fertilizantes e alimentos; como electrólito nas pilhas; em composições pirotécnicas, entre outras. Material/Equipamento: ▪ Balança analítica de precisão +/- 0,01g ▪ 2 balões volumétricos de 50mL ▪ Copo de 100mL ▪ Espátula ▪ Esguincho com água desionizada ▪ Pipeta volumétrica de 25mL ▪ Proveta de 25mL ▪ Vareta de vidro ▪ Funil Reagentes: ▪CuSO4 ▪H2O Procedimento: I parte: Pesagem do soluto 1- Calcular a massa de soluto necessária para a preparação da solução de concentração 0,02 mol dm-3. 2- Colocar com a ajuda de uma espátula o soluto, pouco a pouco, no copo sem deixar cair no prato da balança. 3- Tentar obter um valor aproximado do pretendido. 4- Não retirar o excesso de sólido, a não ser para um novo recipiente, com a indicação “sulfato de cobre técnico”. 5- Registar o valor exacto da massa. Este procedimento pode traduzir-se pelo seguinte diagrama de fluxo:
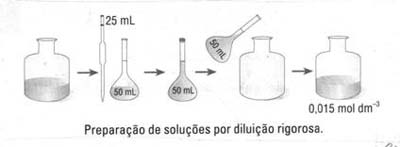
II parte: Dissolução do soluto 1 - Adicionar cerca de 25mL de água desionizada ao copo que contém o soluto; agitar até completa dissolução. 2 - Transferir a solução para o balão volumétrico; lavar o copo, o funil e a vareta com pequenas porções de água desionizada e transferir essas águas de lavagem para o balão. 3 - Adicionar água desionizada até ao traço de referência; agitar bem para homogeneizar. 4 - Transferir a solução para um frasco de vidro devidamente lavado e passado pela solução recém-preparada. 5 - Rolhar e rotular o frasco indicando o nome da solução e da sua preparação e a sua concentração exacta, calculada a partir da massa utilizada. 6 - A actividade experimental só estará terminada após de limpa e arrumada a bancada. Este procedimento pode traduzir-se pelo seguinte diagrama de fluxo:
Medidas de Segurança: ▪ Usar óculos de segurança ▪ Lavar os salpicos dos produtos químicos com sabão e água corrente
Outros Trabalhos Relacionados
|
|