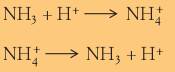|
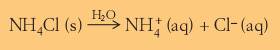
IntroduçãoObjectivo: descobrir qual das amostras (A ou B) tem amónio, separando as duas amostras e fazendo análise em paralelo. Certos produtos “lava tudo” ou limpa-vidros e alguns adubos mencionam a presença de azoto amoniacal na sua constituição, muitas vezes utilizando simplesmente a palavra “amoniacal”. O que é o amoníaco? A substância amoníaco, de fórmula química NH3, é gasosa à temperatura ambiente e à pressão normal. O amoníaco tem as seguintes características: . À temperatura ambiente e pressão normal é um gás tóxico, incolor e inflamável, com cheiro característico picante e intenso; . À pressão normal o seu ponto de fusão é de -78ºC e o seu ponto de ebulição é de -33ºC; . É altamente solúvel em água. A molécula de amoníaco é formada por um átomo de azoto ligado a três átomos de hidrogénio. O que são produtos amoniacais? Produtos amoniacais são produtos que possuem na sua constituição química azoto amoniacal, ou seja, são compostos por um elemento chamado azoto (N2), sob a forma de amoníaco (NH3) e/ou compostos de amónio (NH4+), consoante o produto. Os compostos de amónio, como por exemplo o cloreto de amónio, dissociam-se em água libertando o ião amónio:
A designação das duas espécies (NH3 e NH4+) em conjunto justifica-se pelo facto de se poderem transformar ema na outra, o que pode ser descrito por:
Estamos perante uma reacção directa e a respectiva reacção inversa. Vantagens dos produtos amoniacais O amoníaco está presente naturalmente nos solos, como resultado da decomposição de matéria orgânica. Como se liberta para o ar, é também um dos componentes da atmosfera terrestre. O amoníaco quando puro tem várias aplicações e quando usado em misturas, mantém algumas das suas propriedades mais importantes.
Fig. 1 Produtos amoniacais (Retirado de 11Q)
O amoníaco reage facilmente com as gorduras da sujidade originando substâncias solúveis em água, o que permite remover facilmente a sujidade. Alguns constituintes de produtos amoniacais deixam um resíduo que permanece nas superfícies limpas mesmo depois da secagem. No entanto, como o amoníaco é um gás, quando o produto de limpeza amoniacal seca, liberta-se para a atmosfera amoníaco. A principal utilização do amoníaco é como matéria-prima na preparação de novas substâncias. É usado em várias indústrias, destacando-se a produção de fertilizantes agrícolas. O azoto é um importante nutriente para a vida vegetal, podendo ser fornecido através de adubos na forma amoniacal (amoníaco) ou na forma nítrica (nitratos). Embora o azoto amoniacal não seja directamente utilizável pelas plantas, tem a vantagem de ser mais facilmente retido pelo solo. A síntese do amoníaco O amoníaco produz industrialmente usando os gases azoto, N2, e hidrogénio, H2, com matérias-primas. A reacção de síntese do amoníaco é representada pela equação química: N2 (g) + 3H2 (g) → 2NH3 (g) Como detectar azoto amoniacal? Os testes que efectuei para detectar azoto amoniacal em produtos comercias foram efectuados em pequena escala, ou seja, utilizei quantidades reduzidas de reagentes. Os testes em pequena escala permitem: . Diminuir os custos; . Facilitar a eliminação de resíduos; . Diminuir o risco associado à manipulação de reagentes perigosos. Os ensaios realizados permitiram detectar a presença de amoníaco (NH3). MaterialExperiência I . Produto comercial A
Fig. 2 Produto A . Produto comercial B
Fig. 3 Produto B . Hidróxido de sódio concentrado (NaOH) . Ácido clorídrico concentrado (HCL) . Placa de aquecimento . Gobelé . Conta gotas . Tubos de ensaio . Suporte para tubos de ensaio . Papel vermelho de tornesol . Vareta de vidro Experiência II . Produto comercial A . Produto comercial B . Solução diluída de sulftato de cobre (CuSO4) . Solução concentrada de hidróxido de sódio (NaOH) . Conta gotas . Tubos de ensaio . Suporte para tubos de ensaio Experiência III . Produto comercial A . Produto comercial B . Reagente de Nessler . Água deslidada . Sonasol . Conta gotas . Tubos de ensaio . Suporte para tubos de ensaio ProcedimentoI. Identificação de azoto amoniacal I 1. Efectuou-se o seguinte ensaio com o produto A: a) Colocou-se uma amostra de 10 gotas de produto num tubo de ensaio pequeno.
Fig. 4 Colocação de produto A Fig. 5 Colocação do produto B num tubo de ensaio b) Adicionou-se duas gotas de hidróxido de sódio.
Fig. 6 Junção de hidróxido de sódio c) Aqueceu-se em banho de água.
Fig. 7 Aquecimento dos tubos de ensaio em banho de água d) Aproximou-se da boca do tubo de ensaio um pouco de papel de tornesol humedecido com água. Observou-se e registou-se: . Positivo – papel fica azul: contém azoto amoniacal . Negativo – papel permanece vermelho: não contém azoto amoniacal e) Aproximou-se da boca do tubo de ensaio a ponta de uma vareta molhada com ácido clorídrico concentrado. Observou-se e registou-se: . Positivo – formação de fumos brancos: contém azoto amoniacal . Negativo – não se formam fumos brancos: não contém azoto amoniacal. 2. Repetiu-se o mesmo ensaio com o produto B. II. Identificação de azoto amoniacal II 1. Efectuou-se o seguinte ensaio com o produto A: a) Colocou-se 20 gotas de solução de sulfato de cobre diluída num tubo de ensaio. b) Adicionou-se o produto gota a gota. Verificou-se o aparecimento de um precipitado azul claro. Continuou-se a adicionar produto.
Fig. 8 Adição do produto A gota a gota Fig. 9 Adição do produto B gota a gota c) Observou-se e registou-se: . Positivo – há dissolução do precipitado e a solução adquire cor azul escura: contém azoto amoniacal. . Negativo - a solução não adquire cor azul escura: não contém azoto amoniacal. 2. Repetiu-se o mesmo ensaio com o produto B. III. Identificação de azoto amoniacal III 1. Efectuou-se o seguinte ensaio com o produto A, com uma amostra-padrão (tubo de ensaio com amoníaco) e com uma amostra de controlo (tubo de ensaio com água destilada).
Fig. 10 Amostra de controlo Fig. 11 Amostra padrão a) Colocou-se 10 gotas de amostra num tubo de ensaio pequeno. b) Adicionou-se 2 gotas de reagente de Nessler.
Fig. 12 Junção do reagente de Nessler c) Observou-se e registou-se: . Positivo: - Precipitado amarelo-acastanhado - pouco azoto amoniacal. - Precipitado vermelho-acastanhado – muito azoto amoniacal. . Negativo – não há mudança de cor: não existe azoto amoniacal. 2. Repetiu-se com o produto B. ResultadosI. Identificação do Azoto amoniacal I d)
Fig. 13 Produto A com papel vermelho de tornesol O produto A muda de cor com o papel vermelho de tornesol. O produto B permanece na mesma cor. e)
Fig. 14 Formação de fumos brancos no produto A No produto A, há formação de fumos brancos. Por outro lado, no produto B isso não se verifica. II. Identificação do azoto amoniacal II Tubo A:
Fig. 15 Tubo A, após adicionado sulfato de cobre O tubo A, após se ter juntado sulfato de cobre obteu-se uma cor azul clara com uma camada superficial azul escura gelatinosa. Tubo B:
Fig.16 Tubo B, após adicionado sulfato de cobre O tubo B, após se ter juntado sulfato de cobre obteu-se uma cor verde clara. III. Identificação do azoto amoniacal III Tubo 1 à água destilada Tubo 2à amoníaco Tubo 3 à produto A Tubo 4 à produto O tubo 1 não há mudança de cor, ou seja, não apresenta azoto amoniacal. O tubo 2 tem muito azoto amoniacal, obtendo-se um precipitado vermelho-acastanhado. O tubo 3 tem muito azoto amoniacal. O tubo 4 muda de cor, mas apresenta pouco azoto amoniacal. Reacções químicas I. Identificação do azoto amoniacal I NH3 (aq) + H2O (l) → NH4+ (aq) + OH –(aq) Torna azul o papel vermelho de tornesol. NH4+ (aq) + Cl – (aq) → NH4Cl (s) Formação de fumos brancos no tubo de ensaio. II. Identificação do azoto amoniacal II Cu2+ (aq) + 2OH- (aq) → Cu (OH)2 (s) Forma-se uma cor azul gelatinosa. Cu (OH)2 (s) + 4NH3 (aq) → [Cu (NH3)4]2+ + 2OH- (aq) Forma-se uma cor azul escura. III. Identificação do azoto amoniacal III NH3 (aq) + 2[HgL4](aq) + 3OH- (aq) → Hg2O (NH2) l (s) + 7I- (aq) + 2H2O (l) Reagente de Nessler Forma-se um precipitado vermelho-acastanhado, isto é, apresenta uma grande percentagem de azoto amoniacal. Análise dos resultadosI. Identificação do azoto amoniacal I Neste teste, o amoníaco é libertado por aquecimento da amostra e é detectado devido ás suas propriedades alcalinas: ele torna azul o papel de tornesol humedecido com água. Pode também ser detectado por reacção com cloreto de hidrogénio (HCl), já que nessa reacção se formam fumos brancos de cloreto de amónio. A identificação com o ácido clorídrico requer a presença de uma quantidade considerável de azoto amoniacal, pois de outro modo não se vêem bem os fumos. Um resultado negativo não significa, que não esteja presente azoto amoniacal, pois as quantidades presentes podem ser muito reduzidas que não seja detectada, devido à reduzida sensibilidade do teste. Por outro lado, o teste com o papel de tornesol é mais sensível, porque detecta azoto amoniacal mesmo em quantidades muito reduzidas. II. Identificação do azoto amoniacal II Neste teste, o amoníaco é identificado através de uma cor azul escura que resulta da formação do ião complexo tetraminocobre (II), [Cu(NH3)4]2+ (aq). III. Identificação do azoto amoniacal III Nesta parte da experiência foi utilizada uma amostra-padrão e uma amostra de controlo. A amostra de padrão é uma amostra onde se sabe que existe a espécie a analisar (neste caso, o amoníaco). A amostra de controlo é uma amostra que não tem, de certeza, a espécie a analisar (neste caso, a água destilada). Para se detectar o amoníaco e o amónio por formação de um precipitado cor acastanhada utilizou-se o reagente de Nessler (solução alcalina de tetraiodomercurato (II) de potássio). ConclusãoEm suma, podemos concluir que o produto que continha azoto amoniacal (amónio) era o produto A, por todas as razões acima referidas. O produto A era uma produto de limpeza amoniacal – tem amónio – e o produto B era um fertilizante para plantas (substral das plantas).
Fig. 17 Produto A (Retirado de a-portuguesa.webnode.pt)
Fig. 18 Produto B (Retirado de continente.pt) FontesA-portuguesa.webnode.pt Continente.pt Paiva, J. e outros (2009); 11 Q, 1ªedição,Texto Editores, Lisboa Outros Trabalhos Relacionados
|
|