|
INTRODUÇÃO O presente trabalho realizado no âmbito da disciplina de Química tem como principal objectivo de conhecer e dar a conhecer um pouco sobre orbitais moleculares e sua energia. Podemos definir que Orbitais são regiões que circundam o núcleo de um átomo, são divididos em 8 camadas (K, L, M, N, O P, Q e R), cada camada comporta um número de eletrons que são particulas de carga negativas que ficam em movimento nos orbitais. O preenchimento dos orbitais, pelos eletrons, variam de acordo com o número atômico do átomo em questão. ORBITAIS MOLECULARES E SUA ENERGIA Teoria do orbital molecular A Teoria do Orbital Molecular (TOM) é uma alternativa para se ter uma visão da ligação covalente. De acordo com este enfoque, todos os elétrons de valência têm uma influência na estabilidade da molécula (elétrons das camadas inferiores também podem contribuir para a ligação, mas para muitas moléculas simples, o efeito é demasiado pequeno). A TOM considera que os orbitais atômicos da camada de valência dos dois átomos ligantes deixam de existir quando a molécula se forma, sendo substituídos por um novo conjunto de níveis energéticos que correspondem a novas distribuições da nuvem eletrônica. Estes dois novos níveis são chamados orbitais moleculares. Dois orbitais atômicos se combinam para formar dois orbitais moleculares. As funções de onda dos orbitais atômicos são combinadas matematicamente para produzir as funções de onda dos orbitais moleculares resultantes. As distribuições espaciais dos orbitais moleculares Para que o processo de formação dos orbitais moleculares seja realmente efetivo é necessário que os orbitais atômicos tenham energias comparáveis e que eles se sobreponham de maneira significativa. A combinação das funções de onda dos orbitais atômicos consiste em uma subtração e uma adição das funções de onda. O orbital molecular formado pela adição das funções de onda de dois orbitais s é representado por ss e o orbital atômico formado pela subtração das funções de onda é representado por ss*. O contraste entre esses dois orbitais moleculares é gritante. Há obviamente um aumento da densidade eletrônica de carga entre os núcleos no orbital ss e um decréscimo na mesma região no orbital ss*. Por essa razão, o orbital ss é chamado orbital ligante e o orbital ss*, orbital antiligante. O primeiro tende a estabilizar a ligação, enquanto o segundo tende a desestabilizá-la. Ambos são chamados orbitais s porque estão centrados e são simétricos ao redor do eixo de ligação. A combinação de dois orbitais p pode produzir resultados diferentes, dependendo de quais orbitais p são usados. Se o eixo x é o eixo de ligação, então os dois orbitais 2px podem se sobrepor apropriadamente se eles se aproximam segundo um único eixo, como é mostrado na figura abaixo. Os orbitais moleculares resultantes constituem, como antes, um orbital ligante (sx) com carga eletrônica acumulada, e um orbital antiligante (sx*) com decréscimo de carga entre os núcleos. Esses orbitais também são classificados como s porque são simétricos ao redor do eixo de ligação. O índice subscrito x é usado para indicar que eles originaram de orbitais px. Quando dois orbitais 2py e 2pz se sobrepõem para formar orbitais moleculares, eles o fazem lado a lado, como é mostrado na figura abaixo. Em cada caso, o resultado é um orbital antiligante com quatro lóbulos e um orbital ligante com dois lóbulos. Esses orbitais não são simétricos em relação ao eixo de ligação. Em vez disso, eles possuem duas regiões, em lados opostos ao eixo de ligação, nas quais a densidade da nuvem eletrônica é alta. Isso é caraterístico de um orbital p. Observe que, como antes, o orbital ligante permite uma alta concentração da carga eletrônica na região entre os núcleos, enquanto o orbital antiligante mostra uma diminuição da densidade de carga nessa região. Na realidade, cada orbital antiligante tem um plano nodal entre os dois núcleos. ENERGIA DOS ORBITAIS MOLECULARES A energia do orbital molecular antiligante é sempre maior do que a do orbital ligante. No caso de uma molécula diatômica homonuclear, isto é, formada por dois átomos iguais, a relação de energias dos orbitais moleculares entre os orbitais atômicos 1s e os orbitais moleculares resultantes ss e ss* pode ser mostrada pelo diagrama abaixo: Consideremos agora a formação dos orbitais moleculares de um par de orbitais atômicos 2px cujos lóbulos estão dirigidos para o eixo de ligação. Novamente temos um par de orbitais moleculares, um ligante (ss) e outro antiligante (ss*): Em seguida observe os orbitais atômicos 2py e 2pz, que se sobrepõem lado a lado. Os orbitais moleculares formados são mostrados a abaixo. A sobreposição py - py é exatamente igual à sobreposição px - px (exceto pela orientação). Assim, formam-se dois conjuntos de orbitais moleculares de mesma energia: os orbitais py e os orbitais pz (ligantes) e os orbitais p*y e p*z (antiligantes). O preenchimento dos orbitais moleculares Na distribuição eletrônica dos orbitais atômicos os elétrons são adicionados um a um ao diagrama de energia desses orbitais, com o objetivo de se construir a configuração eletrônica dos átomos. Usaremos agora uma técnica semelhante para preencher os orbitais moleculares. Desejamos construir a configuração eletrônica de moléculas diatômicas homonucleares no estado fundamental. Como antes, adicionaremos elétrons a partir da base do diagrama para cima, para os orbitais de maior energia. A molécula mais simples é a de hidrogênio. A figura abaixo mostra o diagrama de energia para os orbitais moleculares da molécula de H2. Os dois elétrons 1s vão constituir um par (de spins opostos) no orbital ss (ligante) da molécula. Este par constitui uma ligação simples. A configuração eletrônica da molécula de hidrogênio pode ser escrita como (ss)2. Consideraremos a seguir, a molécula que poderia ser formada por dois átomos de hélio, cada um dos quais é capaz de fornecer um par de elétrons para a molécula. O total é de quatro elétrons, dois a mais que no H2. A configuração eletrônica no estado fundamental na molécula de He2 deveria ser (ss)2 (ss*)2. Devido ao fato de que o ss* (antiligante) está agora preenchido e seu efeito desestabilizador cancela o efeito estabilizador do orbital ss, não há, realmente, não há força de atração entre os átomos de hélio devido ao número igual de elétrons ligantes e antiligantes e, assim, a molécula de He2 não existe. Na teoria dos orbitais moleculares a ordem de ligação é definida como: elétrons ligantes - elétrons antiligantes Assim, a ordem de ligação na molécula de H2 é (2-0)/2 = 1. Já na molécula hipotética de He2 a ordem de ligação é (2-2)/2 = 0. O valor da ordem de ligação indica o número de ligações feitas entre dois átomos. Desde que o preenchimento de dois orbitais moleculares s formados a partir dos orbitais 1s está completo, passa-se para os dois orbitais moleculares formados a partir dos orbitais 2s. Estes são similares àqueles que já foram preenchidos. Veja outros dois exemplos: Li2 e Be2. Li2 - Essa molécula possui um total de seis elétrons, mas quatro deles estão na camada K (interna) dos átomos de Li. Os elétrons de valência dos dois átomos de Li são usados para preencher um novo orbital molecular ss. Os orbitais atômicos 1s praticamente não são perturbados, e por isso não são mostrados no diagrama. A configuração é muito semelhante à do H2, e a ordem de ligação, que somente pode ser determinada com os elétrons de valência, é 1/2 (2-0) = 1. Representando cada um dos orbitais 1s preenchidos por K (para a camada K), a configuração de Li2 pode ser escrita como: K K (ss)2. Com uma ordem de ligação igual a 1 é possível prever a existência da molécula de Li2. Moléculas diatômicas de lítio não existem no estado líquido ou sólido, mas são encontradas no estado gasoso. Be2 - Considerando a molécula hipotética de Be2, encontraremos uma situação semelhante à do He2. O número atômico do berílio é 4 e dois destes elétrons irão preencher o orbital ss* (veja a figura acima). A desestabilização gerada pelo orbital ss* preenchido cancela o efeito de estabilização do orbital ss. A ordem de ligação é zero e, portanto, a molécula de Be2 não existe. Se existisse, porém, sua configuração eletrônica no estado fundamental seria K K (ss)2(ss*)2. A seguir consideraremos a sequência B2, C2, N2, O2, F2 e Ne2, percorrendo assim, as demais moléculas diatômicas homonucleares do segundo período. Os orbitais moleculares a serem preenchidos são os orbitais ligantes e antiligantes s e p, representados anteriormente. Entretanto, quando tentamos combinar esses dois diagramas em um, encontramos uma pequena dificuldade: A energia relativa dos orbitais py e pz é menor do que a do orbital ss do B2 ao N2, porém maior para o resto da sequência, de O2 até Ne2. A mudança na sequência de energias dos orbitais moleculares entre N2 e O2 ocorre porque px e px*, nesse caso, têm algum caráter s, fato que ignoramos quando decidimos usar a simplificação, combinação de dois orbitais atômicos para formar dois orbitais moleculares. O caráter s nesses orbitais decresce à medida que a carga cresce no período. Por causa disso a energia de sx fica abaixo da energia de py e pz no O2. C2 e N2. Na primeira molécula (B2) há somente um elétron em cada orbital py e pz. Como são orbitais ligantes, e como em todos os níveis de energia mais baixos os elétrons antiligantes compensam exatamente os elétrons ligantes. A ordem de ligação é 1 (podemos chamar a ligação de ligação simples, mas talvez ela seja melhor descrita como duas meias ligações). Note que os orbitais py e pz têm igual energia, e assim, os dois elétrons não se emparelham no mesmo orbital. Por ocuparem diferentes orbitais, os elétrons podem ocupar regiões diferentes do espaço, evitando um ao outro e reduzindo a repulsão inter-eletrônica. A configuração eletrônica no B2 é escrita como K K (ss)2(ss*)2(py)1(pz)1. A base experimental para essa configuração provém das medidas magnéticas: B2 é paramagnético, e as medidas indicam que existem dois elétrons desemparelhados na molécula. Como o Li2, 0 B2 não é uma molécula que você possa encontrar em um frasco, nas prateleiras do almoxarifado. 0 boro elementar é encontrado como um sólido, no qual o arranjo dos átomos de B é bastante complexo. A temperaturas muito altas, entretanto, as moléculas de B2 podem ser detectadas no estado gasoso. C2 - Adicionando mais dois elétrons (um para cada átomo), obteremos a configuração para o C2,. Esses elétrons são adicionados aos orbitais py e pz, preenchendo-os. Todos os elétrons estão agora emparelhados e, assim, C2 não é paramagnético. A ordem da ligação no C2 é 2, porque há quatro elétrons ligantes a mais na molécula. A configuração eletrônica no C2 é K K (ss)2(ss*)2(py)2(pz)2. Como a ordem de ligação é diferente de zero, o C2 deve existir e, na verdade, ele já foi detectado, a altas temperaturas. N2 - O último preenchimento do diagrama de orbital molecular na figura abaixo é o da molécula de nitrogênio (N2). Ele tem um conjunto de seis elétrons de ligação, que corresponde a uma ordem de ligação igual a 3. Estes elétrons ocupam os orbitais py e pz e px, dando ao N2 a configuração K K (ss)2(ss*)2(py)2(pz)2(px)2. A molécula de N2 é, sem dúvida, muito estável e comum. As medidas magnéticas indicam que todos os elétrons estão emparelhados no N2 (não é paramagnético). O modelo de orbital molecular do N2 está de acordo com a teoria da Teoria da Ligação de Valência (TLV) e os seis elétrons dos orbitais py e pz e px correspondem aos seis elétrons da estrutura de Lewis. O2 - A adição de mais dois elétrons à configuração do N2 leva ao preenchimento dos níveis do O2, como aparece esquerda na próxima figura (abaixo). Observe que esses dois elétrons devem ir para orbitais antiligantes, resultando em um decréscimo na ordem de ligação (de 3, no N2) para 2. O valor mais baixo da ordem de ligação é consistente com o fato de o O2 ter uma energia de ligação menor e uma distância de ligação maior que o N2. A configuração eletrônica do O2 é K K (ss)2(ss*)2(sx)2(py)2(pz)2(py*)1(pz*)1. Um dos primeiros triunfos da teoria do orbital molecular foi a sua capacidade de mostrar que a molécula de O2 é paramagnética (sua configuração eletrônica mostra que ele tem dois pares de elétrons desemparelhados). Os fatos experimentais indicam que esta molécula é paramagnética e tem uma energia de ligação muito alta e uma distância de ligação muito curta. O modelo de orbital molecular está de acordo com as características magnéticas e de ligação observadas. F2 - A adição de mais dois elétrons nos dá o diagrama que é mostrado no centro da figura abaixo. Como os orbitais p* estão ambos preenchidos, a ordem de ligação no F2 é igual a 1. Isto está de acordo com os dados experimentais determinados para a energia e o comprimento da ligação, pois ambos são aqueles esperados para uma ligação simples. Além disso, F2 mostra ser diamagnético, o que é consistente com a ausência de elétrons desemparelhados. A configuração do F2 é K K (ss)2(ss*)2(sx)2(py)2(pz)2(py*)2(pz*)2. Ne2 - A adição de mais dois elétrons preenche o orbital sx*, reduzindo a ordem de ligação para zero. O estado fundamental para Ne2 nunca foi observado. Se esta molécula existisse, sua configuração eletrônica seria K K (ss)2(ss*)2(sx)2(py)2(pz)2(py*)2(pz*)2(sx*)2. OBS: Moléculas diatômicas contendo átomos diferentes são chamadas heteronucleares. As diferenças de eletronegatividade entre os átomos fazem com que as distâncias de ligação e as energias dos orbitais moleculares sejam diferentes das moléculas diatômicas homonucleares. Em muitos casos, porém, uma molécula diatômica heteronuclear tem a mesma configuração da molécula diatômica homonuclear, que possui o mesmo número de elétrons com a qual é isoeletrônica. Assim, por exemplo, a configuração eletrônica do CO é a mesma do N2. NÚMEROS DE ORBITAIS MOLECULARES Onde N é o número de orbitais atômicos usados na aproximação. Os quadrados dos coeficientes , isto é , representam o peso de uma dado orbital atômico na construção da função de onda molecular e conseqüentemente a probabilidade de se encontrar o elétron no orbital molecular na vizinhança dos núcleos pertencentes ao sistema molecular em questão. No caso particular da molécula de H2, que tem dois elétrons, a função de onda para estado fundamental a é expressa como um produto de funções mono-eletrônico, como a seguir; LIGAÇÕES DOS HIDROCARBONETOS Os hidrocarbonetos tem uma série de divisões sendo: 1. hidrocarbonetos saturados, englobando alcanos e cicloalcanos, que não possuem ligações dupla, tripla ou aromática; 2. hidrocarbonetos insaturados, que possuem uma ou mais ligações dupla ou tripla entre átomos de carbono (entre eles os alcenos, alcadienos e cicloalcenos - com ligação dupla; alcinos - com ligações tripla -; e aromáticos) O número de átomos de hidrogênio em hidrocarbonetos pode ser determinado, se o número de átomos de carbono for conhecido, utilizando as seguintes equações: . Alcanos: CnH2n+2 . Alcenos: CnH2n . Alcinos: CnH2n-2 . Ciclanos: CnH2n . Ciclenos: CnH2n-2 Hidrocarbonetos geralmente líquidos geologicamente extraídos são chamados de petróleo (literalmente "óleo de pedra") ou óleo mineral, enquanto hidrocarbonetos geológicos gasosos são chamados de gás natural. Todos são importantes fontes de combustível. Hidrocarbonetos são de grande importância econômica porque constituem a maioria dos combustíveis minerais (carvão, petróleo,gás natural, etc.) e biocombustíveis como o plásticos, ceras, solventes e óleos. Na poluição urbana, esses compostos - juntamente com NOx e a luz solar - contribuem para a formação do ozônio troposférico.
Hidrocarbonetos cíclicos No caso dos hidrocarbonetos cíclicos a estrutura da molécula é fechada. O nome é obtido juntando o prefixo ciclo ao nome da molécula de cadeia aberta correspondente (butano - ciclobutano; propano - ciclopropano). Cicloalcanos Compostos com cadeia cíclica saturada, de fórmula geral CnH2n, com n > 2. Cicloalcenos Compostos com cadeia cíclica com uma ligação dupla, de fórmula geral CnH2n-2, com n > 2. Cicloalcinos Compostos com cadeia cíclica com uma ligação tripla, de fórmula geral CnH2n-4, com n > 2. Hidrocarbonetos aromáticos Estes hidrocarbonetos são baseados na molécula de benzeno C6H6, e têm cheiros característicos. Os hidrocarbonetos não aromáticos também são designados por alifáticos (alcanos, alcenos, alcinos). REGRAS DE ACTETO
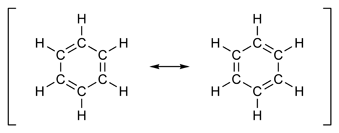
Regra do octeto As ligações químicas no dióxido de carbono - o átomo central (carbono) está rodeado por 8 electrões, de acordo com a regra do octeto, formando uma molécula estável. A regra do octeto, fundamentada na chamada teoria do octeto, é uma regra química simples, segundo a qual os átomos tendem a combinar-se de modo a ter, cada um, oito elétrons na sua camada de valência, ficando com a mesma configuração eletrônica de um gás nobre. A regra é aplicável aos principais grupos de elementos, especialmente ao carbono, nitrogênio, oxigênio e halogênio, mas também a metais como o sódio ou o magnésio. De forma resumida: as moléculas ou íons tendem a ser mais estáveis quando a camada de elétrons externa de cada um dos seus átomos está preenchida com oito elétrons. De fato, parte-se do princípio que, na natureza, todos os sistemas tendem a adquirir a maior estabilidade possível. Os átomos, por exemplo, ligam-se uns aos outros formando moléculas para aumentar a sua estabilidade. De acordo com esta teoria, os átomos dos elementos ligam-se uns aos outros na tentativa de completar a sua camada da valência. Isso pode ser conseguido de diversas maneiras, dando origem a diversos tipos de ligações químicas, que incluem a partilha de elétrons entre átomos. Contudo, existem arranjos menos estáveis que o de um gás nobre que ocorrem regularmente nos metais de transição. História No final do século XIX já se sabia que os compostos de coordenação (antes designados como compostos moleculares) eram formados pela combinação de átomos ou moléculas, de tal maneira que as valências dos átomos envolvidos ficavam aparentemente "satisfeitas". Em 1893, Alfred Werner demonstrou que o número de átomos ou de grupos associados a um átomo central (ou seja, o "número de coordenação") era geralmente de 4 ou 6. Ocorrem, por vezes, outros números de coordenação até 8, contudo, de forma menos frequente. Em 1904 Richard Abegg formulou o que hoje é conhecido como regra de Abegg, que estabelece que a diferença entre o máximo positivo ou negativo de valências de um elemento é, frequentemente, oito. Esta regra foi, depois, usada em 1916 quando Gilbert Lewis formulou a "regra do octeto" na sua teoria do átomo cúbico. Gases Nobres Os átomos dos gases nobres são os únicos que possuem a camada da valência completa, isto é, com oito electrões (ou dois, no caso da camada K). A saturação da camada da valência com oito electrões (ou dois, no caso da camada K) aumenta a estabilidade do átomo, ocasionando o que se designa como configuração estável. Por terem o octeto completo, os gases nobres raramente se combinam com outros elementos, para reagir precisam ser submetidos a condições muito especiais de temperatura e pressão, e com elementos extremamente reativos como, por exemplo, o flúor. A regra de octeto diz que para se tornar estável, um átomo precisa ter 8 elétrons em sua camada de valência, imitando a configuração de um gás nobre. ORDEM DE LIGAÇÃO Ordem de ligação é o número de ligações químicas entre um par de átomos. Por exemplo, no nitrogênio diatômico N≡N a ordem de ligação é 3, enquanto no acetileno H-C≡C-H a ordem de ligação entre os dois átomos de carbono também é 3, e a ordem de ligação de C-H é 1. A ordem de ligação dá uma indicação para a estabilidade de uma ligação. Em um contexto mais avançado, a ordem de ligação não precisa ser um número inteiro. Um bom exemplo disto são as ligações entre átomos de carbono na molécula de benzeno, onde os orbitais moleculares deslocalizados contém 6 elétrons pi em seis carbonos, essencialmente, rendendo um meia ligação pi. Juntamente com a ligação sigma cuja ordem de ligação é de 1,5. Além disso, ordens de ligação de 1,1 , por exemplo, podem resultar de cenários complexos e, essencialmente, referir-se a resistência ao cisalhamento em relação a ligações de ordem 1. Ordem de ligação é um termo científico usado para descrever o número de pares eletrônicos compartilhados entre os átomos que formam a ligação covalente. O tipo mais comum de ligação covalente é a simples, em que ocorre o compartilhamento de um único par eletrônico entre dois átomos individuais. Aquelas em que mais de um par é compartilhado são chamadas ligações covalentes múltiplas. O compartilhamento de dois pares é denominado de ligação dupla, e o de três, ligação tripla. Um exemplo de ligação dupla ocorre no ácido nitroso (entre N e O), e um exemplo de ligação tripla ocorre no cianeto de hidrogênio (entre C e N). Ligações quádruplas, embora raras, também existem. Tanto o carbono quanto o silício podem teoricamente formá-las; entretanto, as moléculas formadas são extremamente instáveis. Ligações quádruplas estáveis são observadas, normalmente entre dois metais de transição em compostos organometálicos. Ligações de ordem 6 também foram observadas em metais de transição na fase gasosa e são ainda mais raras. Principais Características das ligações e substâncias covalentes e moleculares: . Sempre que ocorrer ligações covalentes, todos os átomos envolvidos precisam receber electrões para atingir a estabilidade ou completar sua camada de valência. . Neste caso ocorrerá com os não-metais e hidrogênio, pois um necessita do outro para atingir sua estabilidade, sendo que o hidrogênio não irá perder seu átomo apenas compartilhar com um elemento o grupo dos não metais por exemplo:o CL-(Cloro). . As substâncias moleculares são, em geral, líquidas ou gasosas, entretando não são bons condutoras de eletridade e sim as soluções iônicas que são bons condutores eletricidade. . As substâncias covalentes são sólidos que apresentam altíssímos pontos de fusão e ebulição. As suas macromoléculas apresentam diferenciação formando dessa forma um grande conjuntode átomos, por exemplo: C(grafite) C(diamante), apresentam diferenciação nas suas macromoléculas durante. RESSONÂNCIA A ressonância (denominada também por mesomeria) em química é uma ferramenta empregue (predominantemente em química orgânica) para representar certos tipos de estruturas moleculares. A ressonância molecular é um componente chave na teoria da ligação covalente e a sua manifestação aumenta quando existem ligações duplas ou triplas em moléculas. Numerosos compostos orgânicos apresentam ressonância, como é o caso dos compostos aromáticos.
Estruturas de ressonância do benzeno (Exemplo clássico) História O conceito de ressonância foi introduzido por Linus Pauling no ano de 1928. Inspirou-se em determinados processos probabilísticos da mecânica quântica, no estudo do ion H2+ que possui um eletron deslocalizado entre os dois núcleos de hidrogênio. O termo alternativo que aparece na literatura, mesomerismo (mesomérico), é muito popular nas publicações realizadas em língua alemã e francesa, e foi introduzido por Christopher Ingold, em 1938. O conceito actual de efeito mesomérico adquiriu um significado diverso, mas relacionado. O símbolo da dupla flecha foi introduzido pelo químico alemão Arndt, que denominou este efeito em alemão como zwischenstufe, algo como fase intermédia. Devido à confusão que gerava na comunidade científica a terminologia ressonância, foi sugerido abandonar este nome em favor de deslocalização. Em física, ressonância é a tendência de um sistema a oscilar em máxima amplitude em certas frequências, conhecido como 'frequências ressonantes'. Nessas frequências, até mesmo forças periódicas pequenas podem produzir vibrações de grande amplitude, pois o sistema armazena energia vibracional. Quando o amortecimento é pequeno, a frequência de ressonância é aproximadamente igual a frequência natural do sistema, o que é a frequência de vibrações livres. O fenômeno da ressonância ocorre com todos os tipos de vibrações ou ondas; mecânicas (acústicas), eletromagnéticas, e funções de onda quântica. Sistemas ressonantes podem ser usados para gerar vibrações de uma frequência específica, ou para obter frequências específicas de uma vibração complexa contendo muitas frequências. A ressonância foi descoberta por Galileu Galilei quando começou suas pesquisas com pêndulos em 1602. A ressonância é semelhante ao eco. Este fenômeno tem aplicações importantes em todas as áreas da ciência, sempre que há a possibilidade de troca de energia entre sistemas oscilantes. A aplicação mais palpável é na área das telecomunicações, em que as ondas eletromagnéticas atuam como intermediárias na transmissão das informações do transmissor até o(s) receptor(es), constituindo-se o que se chama sinal. Em mecânica celeste, é comum encontrarem-se períodos orbitais entre astros orbitando o mesmo corpo cuja razão é da forma p/q, sendo p e q números inteiros pequenos. Estes períodos aparecem por causa de forças não-gravitacionais, e são estabilizados pela ressonância. CONCLUSÃO Durante a investigação deste trabalho chegamos a conclusão de que Um OM pode ter energia menor ou maior que a dos orbitais atômicos usados na sua construção. Os orbitais atômicos são como ondas estacionárias centradas (localizadas) nos núcleos atômicos. Entre núcleos distintos, as ondas podem interferir construtivamente entre si, de maneira a aumentar a amplitude total da onda na região internuclear. Nesse ponto, é possível indicar uma região de grande probabilidade de o elétron ser encontrado, caracterizando um sistema ligado. O primeiro princípio da teoria dos orbitais moleculares diz que N orbitais atômicos se combinam linearmente, formando N orbitais moleculares. Para o hidrogênio molecular (H2) são esperados dois orbitais moleculares, que resultam da combinação linear entre dois orbitais atômicos 1s. AGRADECIMENTO Agradecemos primeiramente a Deus por ter nos dado a proteção divida e nos ter dado a vida e a saúde, agradecemos também aos nossos pais por terem nos ajudado bastante e nos terem nos dado força e coragem nos nossos estudos. Agradecemos a todos quanto fizeram parte na elaboração deste trabalho, e ao professor por ter nos abordado um tema muito importante, Orgulhamo-nos por ter encontrado um professor que tem sabido transmitir os conhecimentos com todos os métodos, simples e que facilita a compreensão dos seus alunos, espero que no fim do curso possamos pôr em prática tudo quanto tenmes aprendido para poder transmitir de forma sábia e científica. BIBLIOGRAFIA Este trabalho foi envestigado nos seguintes sites: WWW.google.com.br WWW.notapositiva.com.pt Enciclopédia Wikipéd
http://www.google.com.br/search?hl=pt-BR&biw=1004&bih=551&q=orbitais+moleculares+e+a+sua+energia+&btnG= Outros Trabalhos Relacionados
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||