| Introdução: No âmbito da disciplina de físico e química, foi-nos solicitado pelo professor a realização de uma atividade prático-laboratorial, que se divide em três experiências onde se pretende, respetivamente, determinar a densidade relativa, ponto de fusão e ponto de ebulição. Cada substância é caracterizada por um conjunto de propriedades físicas e químicas, como a densidade, a temperatura de fusão, a temperatura de ebulição, entre outras, que damos o nome de constantes físicas e que permitem identificar substâncias, funcionando como o seu “bilhete de identidade”. A determinação das constantes físicas de uma amostra de substância poderá, servir para identificar essa substância e avaliar o seu grau de pureza, tendo a noção de que todos os materiais contêm impurezas. Introdução Teórica: Para podermos começar as nossas determinações, é essencial sabermos alguns conceitos, como: · Densidade relativa: razão da densidade (massa de uma unidade de volume) de uma substância, em relação a densidade de um material de referência, expresso num valor numérico. · Ponto de fusão: temperatura a que uma substância passa do estado sólido para o estado líquido. Por exemplo, a água pura passa do estado sólido para o estado líquido à temperatura de 0ºC, diz-se então que o ponto de fusão da água é 0ºC. · Ponto de ebulição: temperatura a que uma substância passa do estado líquido para o estado gasoso. Por exemplo, a água pura passa do estado líquido para o estado gasoso à temperatura de 1000ºC, diz-se então que o ponto de ebulição da água é 100ºC. . Ponto de Fusão e Ponto de Ebulição de uma substância pura: durante o aquecimento, quando a substância pura atinge o seu ponto de fusão ou de ebulição, a temperatura deixa de aumentar, mesmo que ela esteja em contato com o calor. Só quando a substância sofre totalmente a mudança de estado . Físico é que a temperatura volta a aumentar. Exemplo de quando aquecemos água pura: · Como se faz o aquecimento? -escolher uma fonte de aquecimento adequada à temperatura de fusão esperada; -controlar a rapidez de aquecimento ±1ºC/min (se a substância sofrer um aquecimento demasiado rápido poderá resultar em erros na determinação); -se se conhecer o ponto de fusão da substância, basta iniciar o aquecimento lento a uma temperatura de 20ºC abaixo de p. f.; -o liquido do banho-maria deverá ser suavemente agitado, durante as experiências; · Grau de pureza: · Banho-maria: processo em que se aquece lenta e uniformemente qualquer substância líquida ou sólida num recipiente, submergindo-o noutro, onde existe água a ferver ou quase; · Substância pura: são substâncias formadas por apenas uma variedade de moléculas. Ou seja, todas as moléculas são iguais. Por isso, possuem um ponto de fusão, solidificação e um ponto de ebulição constantes, e sua composição é bem definida; · Substância impura: são misturas de uma substância principal com outras que constituem a sua impureza; · Pressão: O termo pressão designa a força exercida sobre uma unidade de superfície e mede-se em unidades de força ou de peso dividido por unidades de superfície. Geralmente é utilizada como unidade de pressão 1 atmosfera que corresponde ao peso de uma coluna de mercúrio com 760 mm de altura e 1 cm2 de base (também designada por 760 torr). No sistema internacional de unidades (SI) a unidade de pressão é a força de 1 N exercida sobre 1 m2 e denomina-se pascal (Pa). Comparando, 1 atmosfera = 670 torr = 1,013 x 105 Pa. Uma alternativa utilizada muitas vezes em laboratórios e nos tubos de gases é o quilopôndio por cm2 (kp/cm2), em que 1 atmosfera = 1,033 kp/cm2. · Método da Picnometria: é uma técnica laboratorial utilizada para fazer a determinação da massa específica e da densidade de líquidos. Pode também determinar-se a massa específica e a densidade de sólidos, devendo antes ser dissolvido. · O picnómetro é uma vidraria especial utilizada na picnometria, que possui baixo coeficiente de dilatação. A água é utilizada como substância padrão na picnometria, à temperatura ambiente (25 °C); As substâncias que iremos usar têm as seguintes características: · Acetona: Em química, a acetona (também conhecida como dimetilcetona, 2-propanona, propan-2-ona ou simplesmente propanona) com fórmula química CH3(CO)CH3, é um composto sintético que também ocorre naturalmente no meio ambiente. É um líquido incolor de odor e sabor fáceis de distinguir. Evapora facilmente, é inflamável e solúvel em água. · Álcool Etílico: O etanol (CH3 CH2OH), também chamado álcool etílico e, na linguagem popular, simplesmente álcool, é uma substância obtida da fermentação de açúcares. Tem uma aparência incolor. · Propanol 2: também denominado por álcool isopropílico e isopropanol, uma substância química incolor e de forte odor. É representado pela fórmula C3H8O (H3C - HCOH-CH3). · Naftaleno: também conhecido por naftalina, é um hidrocarboneto aromático. Apresenta a fórmula molecular C10H8. É uma substância cristalina branca, em forma de lâminas, volátil, com um odor degradante. e que arde com chama luminosa. · Whisky: é uma bebida estritamente regulamentada, possuindo designações de origem e várias classes e tipos. A característica comum dessas diferentes classes e tipos é a fermentação dos grãos e a destilação máxima de 80% de álcool para os de milho, e 90% de álcool para os de outros grãos, antes da adição de água, para reter os sabores dos grãos usados para fazer a alcoolização. · Vidro: é uma substância sólida e amorfa que apresenta temperatura de transição vítrea. É um óxido metálico super-esfriado transparente, de elevada dureza, essencialmente inerte e biologicamente inativo. Objetivos: Nesta experiencia prático-laboratorial, existem vários objetivos que se pretendem alcançar, eles são: Na nossa primeira fase experimental pretendemos determinar a densidade relativa de um sólido - pequenas esferas de vidro, a sua densidade varia entre 2,5 g/cm3, e de um líquido – acetona, que tem de densidade 0,79 g/cm3, utilizando a técnica da picnometria para sólidos e para líquidos, e comprarmos os valores tabelados das duas amostras e avaliar o grau de pureza das substâncias. Nesta primeira fase experimental, também pretendemos determinar a densidade do whisky; Na segunda fase da experiência o objetivo é determinar o ponto de fusão de uma amostra sólida – naftaleno, que possui um ponto de ebulição de 80.35 °C, e pretendia-se determinar o ponto de fusão, e compará-lo com o valor tabelado, avaliando assim o seu grau de pureza; E por último, na terceira fase o objetivo é determinar o ponto de ebulição de três amostras, a acetona, o álcool etílico ou etanol e do propanol 2, que têm um ponto de ebulição de 56ºC, 78.4 °C e 82.3ºC, respetivamente. Assim podendo determinar o ponto de ebulição destas duas substâncias, e avaliar os seus graus de pureza. Protocolo Experimental: Procedimento Experimental: Densidade relativa · Esferas de Vidro 1- Ligou-se a balança à eletricidade, e calibrou-se de modo a não existir erros; 2- Começou-se por determinar a massa do vidro de relógio, na balança; 3- Colocou-se no vidro de relógio uma certa quantidade de esferas de vidro, não em demasia; 4- Subtraiu-se ao resultado da massa do vidro de relógio e as esferas com o resultado do vidro de relógio, determinou-se assim a massa da amostra sólida (esferas de vidro) - m; 5- Colocou-se na balança o picnómetro cheio de água (evitou-se a formação de bolhas de ar), e as esferas de vidro ao lado- M; 6- Colocou-se as esferas de vidro no picnómetro; 7- Determinou-se a massa do picnómetro cheio de água com as esferas de vidro dentro do picnómetro- M’; 8- Encontrou-se o resultado da densidade relativa do sólido, a partir da seguinte fórmula: ![]() ; ; 9- Verificou-se assim se a amostra é pura ou impura, dependendo do valor disto na introdução teórica. 10- Lavou-se, todo o material que foi necessário, e arrumou-se os mesmos, no seu devido lugar. · Acetona 1- Mediu-se a massa do picnómetro vazio- m; 2- Encheu-se o picnómetro com água; 3- Mediu-se a massa do picnómetro com água- M; 4- Colocou-se acetona dentro do picnómetro; 5- Mediu-se a massa do picnómetro com acetona- M’. 6- Calculou-se a densidade da acetona, com a seguinte fórmula: ![]() 7- Lavou-se, todo o material que foi necessário, e arrumou-se os mesmos, no seu devido lugar. Para confirmar a densidade da acetona: 1- Introduziu-se um aerómetro dentro da proveta; 2- Foi-se enchendo com acetona a proveta, até a ponta do aerómetro deixar de bater no fundo, e flutuar; 3- Verificou-se assim se a densidade anteriormente calculada dava certo com o valor que apresentava o aerómetro; · Whisky 1- Mediu-se a massa do picnómetro vazio- m; 2- Encheu-se o picnómetro com água; 3- Mediu-se a massa do picnómetro com água- M; 4- Colocou-se acetona dentro do picnómetro; 5- Mediu-se a massa do picnómetro com whisky- M’. 6- Calculou-se a densidade do whisky, com a seguinte fórmula: ![]() 7- Lavou-se, todo o material que foi necessário, e arrumou-se os mesmos, no seu devido lugar. Para confirmar a densidade do whisky: 1- Introduziu-se um aerómetro dentro da proveta; 2- Foi-se enchendo com whisky a proveta, até a ponta do aerómetro deixar de bater no fundo, e flutuar; 3- Verificou-se assim se a densidade anteriormente calculada dava certo com o valor que apresentava o aerómetro; 4- Lavou-se, todo o material que foi necessário, e arrumou-se os mesmos, no seu devido lugar. Ponto de fusão · Naftaleno 1- Montou-se o suporte universal; 2- Colocou-se alguma amostra de naftaleno no vidro de relógio; 3- Partindo do vidro de relógio, colocou-se alguma amostra dentro do tubo capilar; 4- Colocou-se os materiais nos seus devidos lugares: atou-se com um elástico o termómetro ao tubo capilar, agarrou-se o termómetro à garra; 5- Encheu-se uma gobelé com água, e colocou-se em cima da placa de aquecimento; 6- Mergulhou-se o termómetro com o tubo capilar que contém a amostra sólida, no gobelé; 7- Ligou-se a placa de aquecimento à eletricidade; 8- Iniciando-se com um aquecimento lento; 9- Esperou-se pelos devidos resultados, determinando-se o ponto de fusão do naftaleno. 10- Lavou-se, todo o material que foi necessário, e arrumou-se os mesmos, no seu devido lugar. Ponto de ebulição · Acetona 1- Montou-se o suporte universal; 2- Colocou-se um pouco de acetona dentro do tubo de ensaio; 3- Encheu-se o gobelé com água, e colocou-se na placa de aquecimento; 4- Ajeitou-se o termómetro para que passa-se no buraco que a rolha tem, e no buraco mais pequeno que a rolha apresenta, ajeitou-se o tubo capilar; 5- Colocou-se assim a rolha com o termómetro e o tubo capilar, no tudo de ensaio; 6- Ligou-se a placa de aquecimento à eletricidade; 7- Registou-se as temperaturas apresentadas; 8- Observou-se que a amostra começava e entrar no seu ponto de ebulição; 9- Anotou-se os dados pretendidos; 10- Desligou-se a placa de aquecimento; 11- Lavou-se, todo o material que foi necessário, e arrumou-se os mesmos, no seu devido lugar. . Etanol 1- Montou-se o suporte universal; 2- Colocou-se um pouco de etanol dentro do tubo de ensaio; 3- Encheu-se o gobelé com água, e colocou-se na placa de aquecimento; 4- Ajeitou-se o termómetro para que passa-se no buraco que a rolha tem, e no buraco mais pequeno que a rolha apresenta, ajeitou-se o tubo capilar; 5- Colocou-se assim a rolha com o termómetro e o tubo capilar, no tudo de ensaio; 6- Ligou-se a placa de aquecimento à eletricidade; 7- Registou-se as temperaturas apresentadas; 8- Observou-se que a amostra começava e entrar no seu ponto de ebulição; 9- Anotou-se os dados pretendidos; 10- Desligou-se a placa de aquecimento; 11- Lavou-se, todo o material que foi necessário, e arrumou-se os mesmos, no seu devido lugar. Materiais: Os materiais usados para as experiências foram: (sem esquecer o material de segurança que é necessário como a bata, os óculos de proteção, e também umas luvas termorresistentes para poder segurar os gobelés e outro tipo de material que esteja quente) Para a primeira fase da experiência: Densidade Relativa . Picnómetro de sólidos e líquidos . Balança . Pipeta de Pasteur . Vidro de relógio . Sólido-problema (esferas de vidro) . Liquido-problema (acetona e whisky) Para a segunda fase: Ponto de Fusão . Placa de aquecimento: P. Selecta, Combimax. Modo 230A . Amostra de Naftaleno . Vidro de relógio . Termómetro: EQQ 430 - TERMÔMETRO ANALÓGICO (-10º a 110ºC) . Tubos (capilares) para drenagem . Suporte universal com garras . Gobelé de 150ml com ± 200ml de água (para o banho-maria) . Tubo de ensaio . Rolha . Elásticos Para a terceira fase: Ponto de Ebulição . Placa de aquecimento: P. Selecta, Combimax. Modo 230A . Acetona . Álcool Etílico, também chamado de Etanol . Termómetro: EQQ 430 - TERMÔMETRO ANALÓGICO (-10º a 110ºC) . Tubo (capilar) para drenagem . Suporte Universal com garra . Gobelé de 250ml com ± 250 ml de água (para o banho-maria) . Funil . Rolha . Tubo de ensaio Interpretação de Resultados e Respetivos Cálculos: Densidade Relativa: Para calcular a densidade do sólido-problema- esferas de vidro- procedemos aos seguintes cálculos: Massa do vidro de relógio = 25,720g Massa do vidro de relógio + esferas de vidro = 30.888g Massa do sólido-problema = (massa do vidro de relógio - massa do vidro de relógio + esferas de vidro) = 30,888g – 25,720g = 1,168g (m) Massa do picnómetro com água = 41,311g Massa do picnómetro com água + sólido ao lado = 41,311g + 5,168g = 46,479 (M) Massa do picnómetro com água + sólido introduzido = 44,567g (M’) ![]() ![]() Para calcular a densidade do líquido-problema- acetona- procedemos aos seguintes cálculos: Massa do picnómetro vazio = 13,585g (m) Massa do picnómetro cheio de água = 41,311g (M) Massa do picnómetro com o liquido-problema = 35,743g (M’) ![]() Para calcular a densidade do líquido-problema- whisky- procedemos aos seguintes cálculos: Massa do picnómetro vazio = 13,585g (m) Massa do picnómetro cheio de água = 41,311g (M) Massa do picnómetro com o liquido-problema = 40,07 (M’) ![]() Ponto de Fusão: 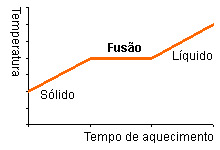 Verificou-se que o naftaleno passou ao estado líquido aos 80.30ºC.  Figura 1: Suporte Universal (montado)  Figura 2: Banho-Maria com a amostra utilizada para o p. f., tubo capilar atado ao termómetro. 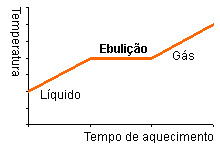 Verificou-se que a acetona passou ao estado gasoso aos 57ºC, o etanol aos 79ºC e o propanol 2 aos 81ºC.  Figura 3: Suporte Universal (montado) + Banho-Maria para o p. e..  Figura 4: Observação de uma impureza na amostra de acetona.  Figura 5: suporte universal + Banho-Maria do álcool etílico  Figura 6: Banho-maria  Figura 7: Banho-Maria da substância propanol 2 Conclusão/Discussão: Densidade Relativa: Nesta primeira atividade, tivemos de realizar a experiência, calcular e determinar o valor da densidade do sólido-problema (esferas de vidro) e do liquido-problema (acetona e whisky), e assim verificar o seu grau de pureza. Com isto concluímos que o resultado da densidade das esferas de vidro não foge muito aos valores tabelados, sendo que determinamos que a amostra das esferas de vidro tinha de densidade 2,7g, e o valor tabelado é de 2,5g/cm3. O valor tabelado da densidade da acetona é de 0,79g/cm3, sendo que o valor que determinamos realizando os cálculos, foi aproximadamente 0,79g, por isso, podemos concluir que a amostra de acetona que utilizamos era parcialmente pura. Para a densidade do whisky, tentámos procurar o seu valor tabelado mas sem efeito, não encontramos o valor da sua densidade, sendo assim não podemos afirmar que é ou não uma substância pura. Com a experiência, determinamos que o valor da densidade do whisky é de 0,95g. Ponto de Fusão: Com a realização da atividade-pratico laboratorial do ponto de fusão do naftaleno, chegámos à conclusão que a amostra que tínhamos era uma substância quase pura pois, o seu valor de ponto de fusão tabelado é de 80.35ºC, e a nossa amostra passou ao estado líquido aos 80.30ºC, como se pode observar na figura 4, vemos que a substância apresenta impurezas na sua composição. Ponto de Ebulição: Nesta ultima experiência, chegámos às seguintes conclusões: Na determinação do ponto de ebulição da acetona, cujo valor tabelado é de 56ºC, com a amostra que nos foi dada a temperatura em que passou ao estado gasoso foi aos 57ºC. Quanto ao etanol e ao propanol 2, os valores tabelados são, respetivamente, 78.4ºC e 82.3ºC. Na realização da nossa atividade o valor em que as sustância passaram ao estado gasoso foi: o etanol aos 79ºC e o propanol 2 aos 81ºC. Assim podemos concluir que as três amostras são quase puras. __________________________________ Outros Trabalhos Relacionados | | Ainda não existem outros trabalhos relacionados | |