|
Corte histológico do
tecido de Resumo O presente trabalho subdividiu-se em duas aulas práticas, durante as quais se procedeu à conservação de Cyathura carinata, através de fixação em parafina e formol. Os cortes realizados tinham a espessura de 10 μm e foram utilizados indivíduos infectados com um tremátode e indivíduos saudáveis. Introdução Cyathura carinata é um isópode vulgar de águas temperadas e turvas [1], como é o caso de estuários. O estuário do Mondego [Coimbra – Portugal] [2], é um local onde abundam esse tipo de isópodes, entre outros, e tremátodes [1]. A convivência de espécies das diferentes ordens culminou com o estabelecimento de uma competição interespecífica: o parasitismo.[1] Apesar de serem infectadas por diferentes tremátodes, o parasitismo em C. carinata mostra-se sempre prejudicial ao hospedeiro, apresentando também danos semelhantes. Quando infectados, estes isópodes, tanto machos como fêmeas, desenvolvem numerosos quistos em redor da cavidade abdominal (do terceiro ao quinto segmento), onde se localiza o aparelho reprodutor da espécie. Esses quistos afectam a capacidade reprodutiva, limitando-a ou mesmo extinguindo-a. [1] Materiais e Métodos O trabalho experimental teve por base o método tradicional de realização de preparações definitivas. O primeiro passo consistiu na colheita. A colheita foi realizada pela docente e foi recolhida no estuário do Mondego diversas Cyathura carinata, tanto infectadas como saudáveis. Foi efectuado um corte do tecido em fragmentos pequenos, no máximo 1cm3, com o auxílio do micrótomo (Micrótomo Saikura Accu-Cut SRM). Os fragmentos foram cortados com bisturi ou faca, não sendo possível cortar com uma tesoura, pois esta pode danificar o tecido. Procedeu-se de seguida à fixação, necessária para evitar a digestão dos tecidos por enzimas presentes no interior das células (autólise) ou por bactérias, preservando o tecido. Para a fixação dos tecidos foram utilizados fixadores químicos (soluções de agentes desnaturantes e que estabilizam as moléculas, fazendo pontes com as moléculas vizinhas). Neste caso utilizou-se formaldeído neutralizado (4 - 5%). O formol tem um poder de fixação devido à sua propriedade desidratante, visto que substitui a água dentro das células a partir da osmose e, assim, os fragmentos muito grandes apenas têm a sua periferia fixada, enquanto que o centro se autolisa. A quantidade de formol foi cinco a dez vezes maior que o volume do material recolhido. A fixação foi feita através de recipientes de armazenamento: frascos de vidro, de abertura larga e com tampa de rosca. O recipiente foi bem fechado, uma vez que o formol é bastante volátil. De seguida realizou-se a descalcificação, que resumiu-se à remoção do excesso de cálcio, para não danificar a lâmina do micrótomo ou distorcer a forma e a distribuição dos elementos do tecido a analisar. O procedimento de tecidos consistiu em várias etapas. A primeira etapa foi o processo de desidratação, em que ocorreu a remoção de fluidos aquosos dos tecidos, através de diversas e sucessivas passagens por álcoois, com diferentes concentrações: etanol, metanol, álcool desnaturado e acetona. Após o etanol, a preparação foi mergulhada em xilol, solvente orgânico miscível com o etanol (agente de desidratação) e com a parafina. O xilol conferiu um aspecto translúcido aos tecidos, por ter índices de refracção semelhantes aos das proteínas. A este processo designa-se por clareamento. Posteriormente, prosseguiu-se à imersão dos tecidos em parafina líquida, utilizando uma cassete. O tecido foi colocado num cesto com a respectiva identificação e colocou-se o cesto no primeiro recipiente de álcool (Recipiente de imersão P-Selecta Termofin) do processador de tecidos (Processador de Tecidos Leica). Iniciou-se o respectivo programa: álcool 60% (2horas) - álcool 80% (2horas)- álcool 90% (2horas)- álcool 100% (2horas)- álcool 100% (2horas)- xilol I (2horas)- xilol II (2horas)- xilol + parafina (1:1) (2horas)- parafina (2horas). Deixou-se secar e ligou-se o dispensador de parafina (Dispensador de Parafina Leica EG 1120), regulando-o a duas temperaturas (58 – 62ºC). Com o auxílio de uma pinça colocou-se o tecido numa placa metálica, vertendo-se a parafina líquida por cima. De seguida colocou-se a placa metálica com o tecido e a parafina numa placa fria (Placa de arrefecimento Kuns Instruments PC-4) de modo a solidificar. Depois do endurecimento da parafina, contendo o indivíduo, procedeu-se ao corte histológico. Retirou-se a preparação da cassete e cortou-se a partir do micrótomo. O micrótomo é um aparelho específico que tem uma lâmina que corta o bloco de parafina onde está embebido o tecido e efectua cortes 3 a 10 µm de espessura. Cada fatia de parafina, mais o tecido, foi retirada para uma lâmina com uma gota de água, executado com a ajuda de uma pinça e uma agulha de dissecação. De seguida a fatia foi cuidadosamente esticada sobre a gota de água e colocada numa estufa a 37ºC para secar onde pode permanecer durante meses. Após a obtenção da fatia com o respectivo tecido, procedeu-se à coloração para puder evidenciar as estruturas celulares que se quer analisar. Existem dois tipos de corantes: corantes básicos que são os corantes com composição basófila; corantes ácidos que são os corantes com composição acidófila. O corante utilizado foi a hematoxilina-eosina. Este corante cora o núcleo normalmente de roxo ou azul violeta, enquanto que a eosina cora o citoplasma de cor-de-rosa, distinguindo-se o citoplasma das diferentes células, assim como as fibras e a matriz de tecidos conjuntivos. Realizou-se o procedimento que baseia-se em mergulhar a lâmina com os cortes parafinados em diferentes tinas. Iniciou-se primeiro pela desparafinação e depois pela Re-hidratação: histolemon (5min)- histolemon (5min)- álcool 100% (5min)- álcool 100% (5min)- álcool 85% (5min)- álcool 70% (5min)- álcool 50% (5min)- água destilada (5min)- hematoxilina de Harris (5min)- eosina (3min); Desidratação II: álcool 70% (1min)- álcool 85% (1min)- álcool 100% (1min)- álcool 100% (1min)- histolemon (5min)- histolemon (5min). Por fim, e após a secagem, realizou-se a montagem entre lâmina e lamela: colocou-se uma gota de bálsamo e depois a lamela. [3] Resultados Os resultados obtidos correspondem às imagens, que foram visualizadas através do microscópio óptico e que depois foram fotografadas, e que correspondem a estruturas de Cyathura carinata.
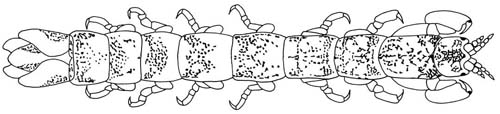
Figura 1 - Cyathura carinata macho
Figura 2 – Esquema das medidas biométricas efectuadas em Cyathura carinata
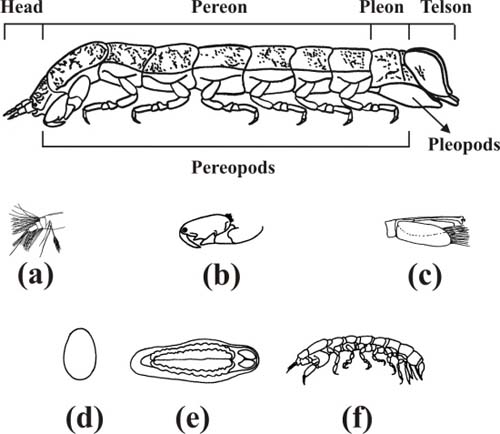
Figura 3 - Ilustração esquemática de Cyathura carinata (Krøyer, 1847) Legenda da Fig.3:
(a): cabeça
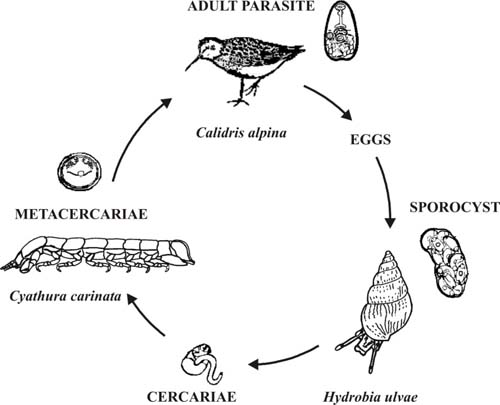
Figura 4 – Ciclo de vida de tremátodes da família Microphallidae
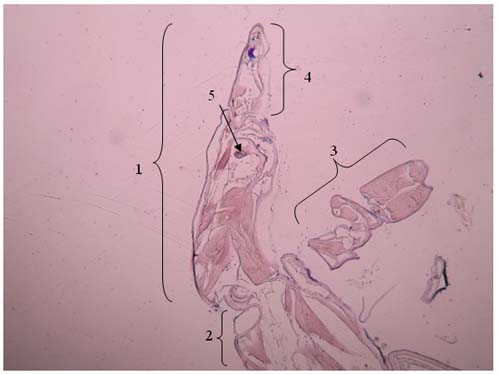
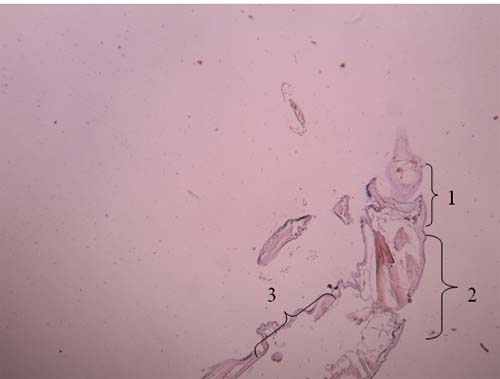
Figura 5 – Primeiro segmento do pereon e gnatopódio (cabeça) de Cyathura carinata Legenda da Fig.5: 1: cabeça 2: início do primeiro segmento 3: antena 4: gnatopódio 5: olho
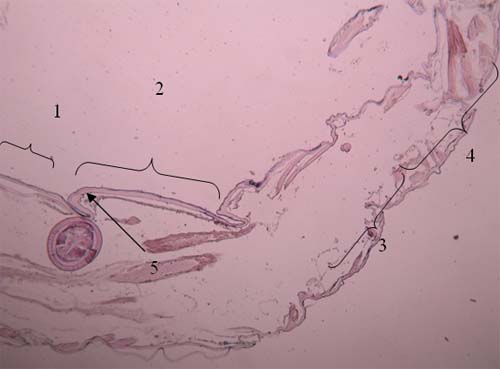
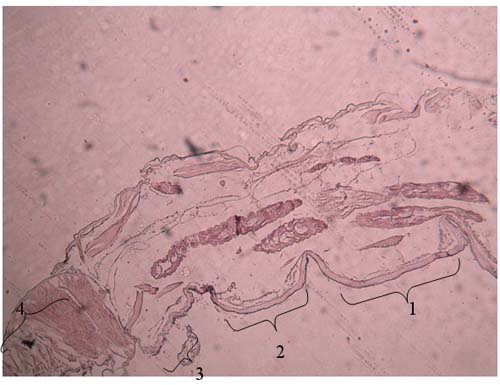
Figura 6 - Quisto de M. subdolum entre 2 e 3º segmentos do pereon de Cyathura carinata Legenda da Fig.6: 1: 2º segmento 2: 3º segmento 3: Quisto de M. subdolum
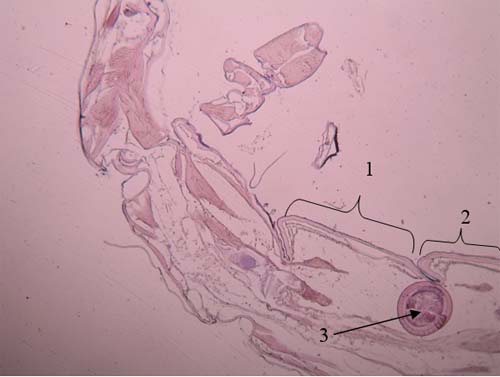
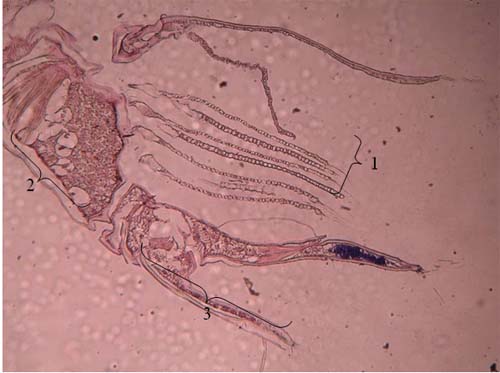
Figura 7 – Quisto, 2º, 3º e 4º segmento do pereon de Cyathura carinata Legenda da Fig.7: 1: 2º segmento 2: 3º segmento 3: 4º segmento 4: Quisto de M. subdolum
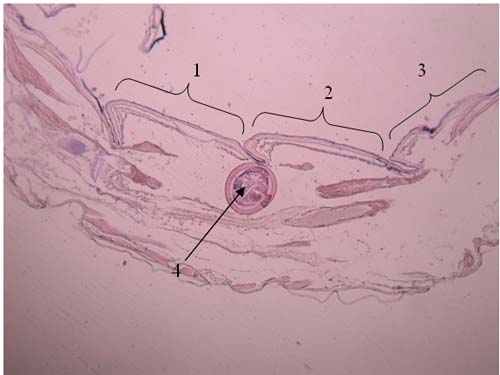
Figura 8 – Quisto, 2º, 3º, 4º, e 5º segmento do pereon de Cyathura carinata Legenda da Fig.8: 1: 2º segmento 2: 3º segmento 3: 4º segmento 4: 5ºsegmento 5: Quisto de M. subdolum
Figura 9 – 5º segmento do pereon e pleon (transição para o pleon) de Cyathura carinata Legenda da Fig.9: 1: pleon 2: telson 3: 5º segmento do pereon
Figura 10 – Pleon com pleopodes e telson de Cyathura carinata Legenda da Fig.10: 1: pleon 2: pleopódios 3: telson
Figura 11 - Parte inicial do pleon, 7º, 6º, 5º segmentos de uma fêmea de Cyathura carinata Legenda da Fig.11: 1: 5º segmento 2: 6º segmento 3: início do pleon 4: 7º segmento
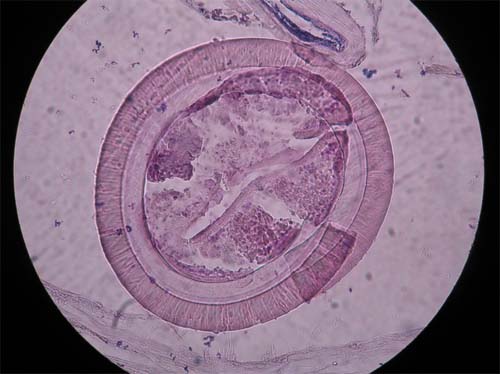
Figura 12 - Quisto de Levinseniella sp.
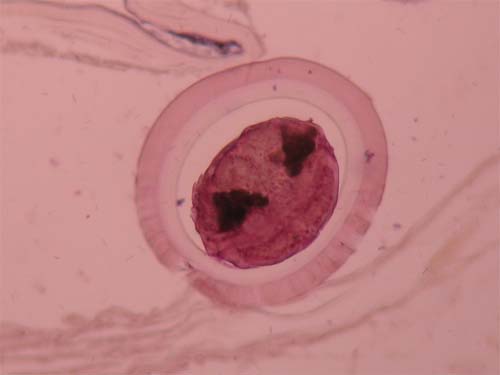
Figura 13 - Quisto de Microphallus claviformis Discussão e Conclusão O trabalho prático realizado revelou-se inconclusivo. De todos os cortes efectuados e de todos os exemplares examinados, apenas se encontrou um quisto (entre o 2º e o 3ºsegmento), não sendo por isso possível concluir qualquer aspecto. Quanto à avaliação dos tecidos do isópode apenas foi possível observar o exoesqueleto e alguns tecidos, sendo no entanto muito poucos. Em suma, apesar de terem sido recolhidos diversos exemplares não foi possível averiguar o quão afectada é a espécie pelos diversos parasitas. Bibliografia [1]- S.M. Ferreira, K.T. Jensen, P.A. Martins, S.F. Sousa, J.C. Marques, M.A. Pardal; “Impact of microphallid trematodes on the survivorship, growth, and reproduction of an isopod (Cyathura carinata)”; Journal of Experimental Marine Biology and Ecology, 2005 [2]- http://pt.wikipedia.org/wiki/Rio_Mondego [3]- Protocolo experimental sobre corte histológico, ano lectivo 2007/2008, Biologia Marinha e Biotecnologia.
Outros Trabalhos Relacionados
|
|