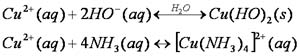|
Objectivo - Saber o que têm em comum os produtos de limpeza amoniacais e os adubos anunciados pela publicidade; - Identificar compostos de amónio e amoníaco, usando testes químicos específicos e concluir que materiais do uso diário têm na sua constituição compostos de amónio (adubos e produtos de limpeza domésticos); - Reconhecer o laboratório como local de trabalho onde têm de ser respeitadas as regras de segurança. Introdução O amoníaco (NH3) é um gás incolor, irritante, inflamável, tóxico e de odor característico e sufocante, muito solúvel na água. A síntese industrial de amoníaco é feita pelo processo de Haber-Bosch, descoberto devido à necessidade de disponibilizar uma maior quantidade de alimentos com o aumento da população mundial, visto que o amoníaco possuía azoto na sua constituição, elemento essencial ao desenvolvimento das plantas. O amoníaco é principalmente usado na síntese de fertilizantes e de catalisadores, na produção de ácido nítrico e como refrigerante. É obtido a partir do azoto atmosférico e do hidrogénio proveniente do gás natural, segundo a seguinte equação química: N2(g) + 3 H2(g) ® 2 NH3(g) Existem adubos simples e adubos compostos, sendo que os primeiros os que contêm apenas um elemento fertilizante (azoto, fósforo ou potássio). Os segundos contêm pelo menos dois dos três elementos fertilizantes referidos. Para além disso, existem também os adubos orgânicos, que se obtêm a partir de matéria de origem vegetal ou animal como, por exemplo, a uréia, o estrume e os adubos verdes. A presença de amoníaco e de compostos de amónio é comum em produtos de limpeza e em adubos é possível de identificar através de testes laboratoriais. Propõem-se quatro testes para cada uma das amostras sendo os resultados obtidos objecto de análise com vista à conclusão sobre a natureza da amostra ensaiada (ter ou não ter amoníaco ou compostos de amónio na sua composição): . Teste A - fumos brancos de NH4Cl (s); . Teste B - detecção do carácter alcalino de uma solução; . Teste C - formação de um composto sólido amarelo – acastanhado; . Teste D - formação de um precipitado/ião complexo. Teste A Produção de cloreto de amónio (sólido) a partir de amoníaco e do cloreto de hidrogénio na fase gasosa. Serve para identificar a presença do amoníaco ou, indirectamente, do ião amónio, já que este na presença de bases fortes origina amoníaco. Se a amostra tiver na sua composição amoníaco ou o catião amónio, formar-se-ão fumos brancos de cloreto de amónio: NH3(g) + HCl(g) ® NH4Cl(s) Fumos brancos Teste B Ensaio comprovativo do carácter alcalino de uma solução, o que acontece se a amostra ensaiada contiver amoníaco ou o catião amónio, o qual origina amoníaco. Aproximando da boca do tubo de ensaio, contendo a amostra devidamente alcalinizada, um pedaço de fita de papel vermelho de tornesol previamente humedecido, aquecendo-se ligeiramente, observa-se a alteração da cor vermelha para azul, o que indica a formação de amoníaco gasoso a partir da amostra, e o carácter alcalino da sua solução aquosa, segundo as equações: NH3(aq) « NH3(g) NH3(g) + H2O(l) ® NH4Cl(aq) + HO-(aq) Teste C Realizado em solução aquosa, serve para identificar o amoníaco, por formação do composto aminado contendo iodo e mercúrio, utilizando o reagente de Nessler (solução alcalina de tetraiodomercurato (II) de potássio). No caso de existir amoníaco ou o catião amónio transformado em amoníaco, formar-se-á um sólido de cor amarelo acastanhado, de cor mais intensa no caso de concentrações mais elevadas. Aproximando-se da boca do tubo de ensaio, contendo a amostra, um pedaço de papel de filtro humedecido com algumas gotas de reagente de Nessler, observa-se o aparecimento da cor amarelo acastanhado indicando a presença de amoníaco. Outro processo alternativo consiste em realizar o ensaio directo, adicionando três gotas de reagente de Nessler a 1 cm3da amostra a analisar (no caso de sólidos, dissolver previamente em água). A presença de amoníaco leva ao aparecimento de um precipitado de cor amarelo acastanhado, no caso de soluções diluídas, e vermelho acastanhado no caso de soluções concentradas. NH4+(aq) + HO-(aq) « NH3(aq) + H2O(l) NH3(aq) + 2[Hgl4]2-(aq) « 7I-(aq) + 3NH4Cl(aq) + HgNI(s) Teste D Realizado em solução aquosa, permite identificar o amoníaco por formação de: - um precipitado gelatinoso azul claro de hidróxido de cobre (II); - um ião complexo, tetraaminocobre (II), de cor azul intensa, segundo as equações:
Adicionando a amostra em análise gota a gota à solução aquosa de sulfato de cobre diluída. No caso de haver amoníaco, aparecerá, de início, uma mistura contendo um precipitado azul claro, Cu(HO)2, e, continuando a adicionar a solução em análise, a mistura adquire uma cor azul intensa, devido à formação de Cu(NH3)4 2+ Frases de Risco e Segurança Ácido Clorídrico (HCl) R34 Causa queimaduras aos olhos, vias respiratórias e pele. R37 Irritante para as vias respiratórias. R50 Muito tóxico para organismos aquáticos. S1/2 Conservar bem trancado e manter fora do alcançe das crianças. S9 Manter o recipiente em local bem ventilado. S16 Manter afastado de qualquer chama ou fonte de ignição - Não fumar. S26 Em caso de contacto com os olhos, lavar imediatamente e abundantemente com água e consultar um especialista. S36/37/39 Usar roupa de protecção apropriada, luvas e protecção de olhos e face. S45 Em caso de acidente ou indisposição consultar imediatamente um médico (se possível mostrar-lhe o rótulo do produto) S61 Evitar a sua libertação para o meio ambiente. Ter em atenção às instruções específicas das fichas de dados de Segurança. Reagente de Nessler R28 Muito tóxico por ingestão. R34 Causa queimaduras aos olhos, vias respiratórias e pele. R48 Risco de efeitos graves para a saúde em caso de exposição prolongada. R24/25 Tóxico em contacto com a pele e por ingestão. R52 Nocivo para os organismos aquáticos. S36/37/39 Usar roupa de protecção apropriada, luvas e protecção de olhos e face. S45 Em caso de acidente ou indisposição consultar imediatamente um médico (se possível mostrar-lhe o rótulo do produto) Material e Reagentes Para a realização da experiência foi necessário o seguinte material e equipamento: . Esguicho com água; . 2 Conta-gotas; . Funil; . Papel de filtro; . Suporte para tubos de ensaio; . Tubos de ensaio; . Vareta de vidro; . Lamparina; Para além disso, foram usados os seguintes reagentes: . Base forte (hidróxido de sódio, por exemplo); . Solução aquosa de ácido clorídrico concentrado; . Solução diluída de sulfato de cobre II; . Reagente de Nessler; . Hidróxido de amónio; . Papel vermelho tornesol; . Adubos (sólidos ou líquidos), limpa-vidros, produtos de limpeza amoniacal. Procedimento Teste A - Pesquisa de Amoníaco com Ácido Clorídrico 1. Colocar um pouco da amostra a analisar num tubo de ensaio. 2. Adicionar umas gotas de hidróxido de sódio (base forte) e homogeneizar, cuidadosamente. 3. Mergulhar uma vareta em ácido clorídrico concentrado e aproximá-la da boca do tubo de ensaio. 4. Registrar o que observa. 5. Repetir todos os passos anteriores para as restantes amostras. Teste B - Pesquisa de Amoníaco com o Indicador Papel Azul Tornesol 1. Colocar um pouco da amostra a analisar, devidamente alcalinizada, num tubo de ensaio. 2. Aproximar da boca do tubo de ensaio um pedaço de fita de papel vermelho de tornesol, previamente humedecida. 3. Registrar a cor da fita. 4. Aquecer ligeiramente a amostra. 5. Aproximar novamente da boca do tubo de ensaio o pedaço de fita de papel azul de tornesol. 6. Registrar a cor da fita. 7. Repetir todos os passos anteriores para as restantes amostras. Teste C - Pesquisa de Amoníaco com o Reagente de Nessler 1. Colocar uma solução da amostra a analisar num tubo de ensaio. 2. Aproximar da boca do tubo de ensaio um pedaço de papel de filtro humedecido com algumas gotas de reagente de Nessler. 3. Registrar a cor do papel 4. Colocar num outro tubo de ensaio metade da mesma amostra utilizada anteriormente. 5. Adicionar três gotas de reagente de Nessler 6. Registrar a cor do precipitado formado. 7. Diluir a outra metade da amostra. 8. Adicionar três gotas de reagente de Nessler. 9. Registrar a cor do precipitado formado. 10. Repetir todos os passos anteriores para as restantes amostras. Teste D - Pesq. Amoníaco com uma Solução diluída de Sulfato de Cobre II 1. Colocar um pouco de solução diluída de sulfato de cobre II num tubo de ensaio e adicionar, gota a gota, a amostra que se está a analisar. 2. Registrar o que observa. 3. Continuar a adicionar, gota a gota, a solução em análise. 4. Registrar a cor da mistura. 5. Repetir todos os passos anteriores para as restantes amostras. Resultados
Tabela 1: Resultados do Teste A nos materiais testados
Tabela 2: Resultados do Teste B nos materiais testados
Tabela 3: Resultados do Teste D nos materiais testados
Tabela 4: Resultados do Teste C nos materiais testados Conclusões Após a realização dos quatro testes para a verificação da existência de amoníaco nos produtos testados, podemos concluir que em todos se verificou a presença de compostos de amónio. Utilizou-se amónia como amostra padrão, pois sabemos à partida que possui amoníaco na sua constituição. Os restantes produtos apresentavam no seu rótulo a existência de compostos de amónio na sua constituição, no entanto, procedemos à sua verificação. No processo em que se utilizou o ácido clorídrico, foi possível observar a libertação de fumos brancos, que evidenciavam a reacção entre o amoníaco e o ácido clorídrico, em que os fumos libertados eram cloreto de amónio. O papel vermelho tornesol revelou-se também um identificador eficaz para o processo em causa. Este indicador corou de azul na presença de hidróxido de amónio que por sua vez se formou pela reacção de amoníaco com a água, daí a necessidade de o papel vermelho de tornesol estar humedecido. No outro processo utilizado para identificar o ião amónio, em que se utilizou o reagente de Nessler foi possível observar a mudança de cor do papel de filtro para amarelo-acastanhado quando o reagente de Nessler reagiu com o amoníaco e com o ião hidróxido. Verificou-se a mudança para a mesma cor quando se juntaram as duas substâncias. Quanto mais concentrada maior era o tamanho das partículas que se formavam e a cor era também mais intensa. Por fim, utilizou-se sulfato de cobre (II) diluído que na presença de amoníaco formava um precipitado gelatinoso azul claro de hidróxido de cobre (II) e á medida que tornávamos a solução mais concentrada ia evoluindo para um ião complexo, tetraminocobre (II), de cor azul intensa. Podemos concluir que quando o ião amónio contacta com uma base forte, como o hidróxido de sódio, reage formando amoníaco e também quando contacta com a água forma uma substância básica (hidróxido de amónio). O trabalho práctico desenvolvido para a identificação do ião amónio nas amostras revelou-se eficaz, sendo possível concluir que ambos os produtos de limpeza (Sonasol e Ajax), assim como o adubo comercial KB possuíam o ião amónio. Bibliografia . http://pt.wikipedia.org/wiki/Amon%C3%ADaco; . http://pt.wikipedia.org/wiki/Desintoxica%C3%A7%C3%A3o_de_amon%C3%ADaco; . http://pt.wikipedia.org/wiki/Processo_de_Haber; . http://cienciaemcasa.cienciaviva.pt/amoniaco.html;
.
http://www.airliquidemedicinal.pt/en/medias/pdf/InfGerais/Documentacao
Outros Trabalhos Relacionados
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||