
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Telmo Roseiro Rodrigues e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Relatório de actividade laboratorial cujo objectivo foi conhecer algumas características das células animais e das células vegetais (Biologia - 10º ano).
Nesta actividade laboratorial, pretendíamos conhecer algumas características das células animais e das células vegetais. À partida, sabíamos que estes dois tipos de células possuíam algumas diferenças, por conseguinte, desejávamos saber mais acerca do assunto, não só as suas diferenças, mas também acerca das suas semelhanças.
Para a observação destes dois tipos de células, utilizámos um instrumento de trabalho ampliador muito útil em situações como esta: o Microscópio Óptico Composto (M.O.C.). Executámos várias observações microscópicas utilizando corantes celulares distintos como meios de montagem.
Nas observações de células vegetais, utilizámos como meio de montagem o azul-de-metileno, o vermelho-neutro e o soluto de lugol/ água iodada. Realizámos também uma observação com água servindo de meio de montagem.
A actividade laboratorial decorreu como planeado no protocolo da mesma, que assumiu uma grande utilidade, nomeadamente ao nível do procedimento experimental, uma vez que nele se encontrava discriminado todos os materiais que deveríamos usar.
O principal objectivo desta actividade laboratorial, como já referido, era conhecer algumas características das células animais e vegetais.
Essas características verificavam-se tanto na composição das mesmas células (constituintes observáveis), como nas funções de cada constituinte.
Não era possível, através da observação microscópica, saber a função dos constituintes das células, no entanto, estava perfeitamente ao nosso alcance, com as condições de trabalho disponíveis, realizar uma série de observações de cada tipo de célula. Essa observação permitia não só visualizar a célula como “um todo”, mas também visualizar alguns constituintes de cada tipo de célula.
É importante mais uma vez referir que foram utilizados corantes celulares distintos na montagem de cada preparação. No entanto, não sabíamos o porquê da sua utilização. Estava assim constituído mais um objectivo ao qual pretendíamos chegar.
A unidade fundamental da vida é a célula. No entanto, a sua existência era desconhecida até à data da invenção do primeiro microscópio, em 1590, por Hans Jansen.

Figura 1 – Célula Eucariótica Animal e os seus constituintes
Actualmente, a teoria celular assenta em três pressupostos:
As células apresentam uma grande diversidade morfológica e funcional. Podem ser classificadas em células procarióticas (células mais simples, que não apresentam núcleo individualizado e perfeitamente organizado) e células eucarióticas, que apresentam uma organização estrutural mais complexa, nomeadamente no que se refere ao núcleo, que aparece completamente organizado e delimitado por um invólucro.
Tanto as células vegetais como as células animais, que vão ser estudadas na presente actividade laboratorial, são células do tipo eucariótico.
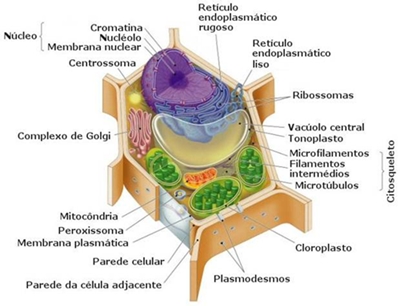
Figura 2 - Célula Eucariótica Vegetal e os seus constituintes
A célula é um sistema aberto. É um sistema, pois contém um conjunto de elementos em interacção ou, de forma mais completa, é um conjunto de elementos em interacção dinâmica, organizados em função de um objectivo. É aberto, porque ocorrem constantes trocas com o meio em que se insere, ora recebendo deste (energia, matéria, informação), ora fornecendo-lhe algo (desperdícios, etc.).
Para iniciar a actividade laboratorial, colocámos o microscópio em cima da mesa de trabalho. Fomos buscar todos os materiais acima referidos, para que o procedimento se realizasse, respeitando fielmente as condições descritas no protocolo da actividade.
Neste primeiro procedimento, pretendia-se fazer a observação de células vegetais.
Começámos a fazer a primeira preparação. Com a pinça, retirámos da epiderme interior da cebola uma fina camada, que cortámos em pequenas porções (aproximadamente 5 mm de lado), com a ajuda do bisturi e da tesoura.

Figura 3 – Retirar a epiderme interior das túnicas da cebola
Colocámos uma gota de azul-de-metileno numa lâmina, para que o mesmo funcionasse como meio de montagem. Posteriormente, colocámos um fragmento que tínhamos cortado anteriormente em cima da gota de azul-de-metileno.
Cobrimos o fragmento com a lamela, primeira fazendo um ângulo de 45º, e depois, baixando a lamela vagarosamente, até que esta o estivesse a cobrir totalmente. Com a ajuda do papel absorvente, limpámos o excesso de azul-de-metileno que se encontrava na lâmina.
Posteriormente, colocámos a lâmina na platina, de modo a que se procedesse à sua observação microscópica.
Utilizámos um poder de ampliação total de 100x. Registámos numa folha de papel a observação que estávamos naquele momento a visualizar.
No entanto, decidimos que também seria importante utilizar uma objectiva com um poder de ampliação maior. Ficámos com um poder de ampliação total de 400x. Procedemos à sua esquematização, tal como já tinha acontecido na visualização anterior.
Depois da visualização das células vegetais utilizando como meio de montagem o azul-de-metileno, repetimos as mesmas, mas desta vez utilizando como meios de montagem o corante vermelho-neutro, e posteriormente, o soluto de lugol. Terminámos a observação das células vegetais utilizando como meio de montagem a água.
Para a execução da observação das células de origem animal, começámos por colocar numa lâmina, uma gota de azul-de-metileno, com a ajuda do conta-gotas. Depois disso raspámos levemente um palito na superfície dorsal da língua. Posteriormente, fizemos com que a parte do palito que tinha sido raspada na língua entrasse em contacto com o corante azul-de-metileno, que se encontrava na lâmina.
Cobrimos a preparação com a lamela, utilizando o processo já em cima referido (primeiro fazendo um ângulo de 45º, e depois, baixando vagarosamente, até que a lamela assentasse totalmente na lâmina). Mais uma vez, com o papel absorvente, limpámos o excesso de azul-de-metileno que se encontrava na lâmina. Executámos visualizações com todos os poderes de ampliação disponíveis, mas só desenhámos a observação originada pelo poder de ampliação total de 400x.
As seguintes imagens mostram os resultados obtidos na execução dos Procedimentos A e B, respectivamente.
| Nota: As seguintes imagens não estão à escala, sendo apenas uma interpretação dos resultados obtidos através da observação microscópica. | ||
| Meio de Montagem | Ampliação | Imagem obtida |
| Azul-de-metileno |
100x 400x |
⊗ ⊗ |
| Vermelho-neutro |
100x 400x |
⊗ ⊗ |
Tabela 1 – Observação de Células Vegetais utilizando azul-de-metileno e vermelho-neutro
Células Vegetais |
||
|
Meio de Montagem |
Ampliação |
Imagem obtida |
| Soluto de lugol/ Água iodada |
400x |
⊗ |
| Água |
400x |
⊗ |
Tabela 2 – Observação de Células Vegetais utilizando soluto de lugol e água
Células Animais |
||
|
Meio de Montagem |
Ampliação |
Imagem obtida |
| Azul-de-metileno |
400x |
⊗ |
Tabela 3 – Observação de Células Animais utilizando azul-de-metileno
No primeiro procedimento, as nossas observações tiveram como objecto de estudo a epiderme da cebola, pois esta apresenta apenas uma camada de células, permitindo-nos, deste modo, observar células eucarióticas vegetais.
Contudo, existem dois aspectos que dificultam a observação dos componentes celulares, sendo eles as pequenas dimensões das células e dos seus organelos, assim como a sua transparência e a consequente falta de contraste entre as estruturas. Por este motivo, existem algumas técnicas de microscopia que facilitam a visualização das microestruturas biológicas, como é o caso da coloração.
Quando vimos a preparação do vermelho-neutro ao M.O.C, conseguimos visualizar os vacúolos, porque reagem com o vermelho-neutro.
Ao observarmos a preparação de azul-de-metileno ao M.O.C., conseguimos identificar melhor o núcleo, pois o núcleo reage com este corante.
Na observação da preparação da água iodada, vimos todas as estruturas da célula: citoplasma, parede celular e núcleo, pois a água iodada cora várias estruturas.
Com a preparação da água, o que observámos ao M.O.C. foram apenas o citoplasma e a parede celular, pois não se conseguia identificar mais nada, por isso é que é necessário usar corantes, consoante o que se pretende ver, pois eles reagem de forma diferente com cada estrutura da célula.
Em todas as observações, conseguimos sempre identificar o citoplasma e a parede celular.
No caso do segundo procedimento (observação das células animais), pudemos distinguir algumas células, no entanto, em bastante menor frequência, uma vez que são de muito menores dimensões que as células vegetais.
As células animais, para além de terem menor dimensão que as vegetais, não possuem parede celular. Foi possível distinguir o núcleo, o citoplasma e a membrana celular, uma vez que utilizámos um corante celular (azul-de-metileno).
Nesta actividade laboratorial, conseguimos alcançar os objectivos que formulámos aquando do seu início.
Conseguimos detectar vários constituintes em cada uma das células, e também detectar algumas das suas diferenças e semelhanças.
Um dos nossos objectivos era igualmente compreender a importância de corantes celulares em cada uma das preparações microscópicas.
A utilização de corantes celulares é bastante importante em microscopia, pois permite evidenciar diversos componentes celulares, alterando o menos possível as suas características originais, proporcionando assim um trabalho mais pormenorizado e credível ao observador.
Esta técnica baseia-se no facto de determinados constituintes celulares absorverem alguns corantes, enquanto outras estruturas não o fazem. Foi através do conhecimento desta técnica que utilizámos o azul-de-metileno, o soluto de lugol e o vermelho-neutro para evidenciar o núcleo, a parede celular e os vacúolos das células da epiderme da cebola.
Com a utilização do azul-de-metileno, (corante que usado em baixa concentração penetra na célula sem a matar – corante vital) através da técnica de imersão (consiste em colocar o corante na lâmina, actuando como meio de montagem, seguindo-se a colocação do material em estudo), este manteve o citoplasma e alguns organitos incolores, tendo apenas sido absorvido pelo núcleo, que ficou com uma tonalidade azul. Nesta observação, tivemos alguma dificuldade em visualizar o núcleo das células, pois este corante é bastante escuro, tornando a observação difícil.
Por outro lado, ao utilizar o vermelho-neutro, que à semelhança dos outros dois corantes utilizados também é um corante vital, este introduziu-se no vacúolo, conferindo-lhe uma cor rosada ou avermelhada.
Utilizando o soluto de lugol, que também é um corante vital, foi-nos possível verificar de forma acentuada a parede celular e o núcleo, uma vez que só estes componentes celulares absorveram o corante, ficando com uma tonalidade amarela, permitindo-nos assim realçar estruturas que não contrastavam suficientemente umas em relação às outras.
No entanto, sendo as células da epiderme da cebola células eucarióticas vegetais, era de esperar que se observassem cloroplastos, o que não acontece, pois a cebola é um caule subterrâneo, logo não efectua fotossíntese (processo de síntese de matéria orgânica que ocorre nas células dos produtores, envolvendo os pigmentos que se encontram nos cloroplastos) e, por isso não possui estas estruturas, pois não necessita delas.
Em anexo (no final do relatório) encontra-se um conjunto de duas folhas, que constituem os apontamentos realizados sobre a actividade laboratorial.