
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Cláudia Viegas e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Actividade Prática Laboratorial cujo objectivo foi preparar 50,0 cm3 de uma solução aquosa de tiossulfato de sódio de concentração 0,030 mol/dm-3 e preparar soluções a partir desta com o factor de diluição 5, realizado no âmbito da disciplina de Química (10º ano).
Uma solução aquosa é uma solução onde o solvente é a água e o soluto é uma substância qualquer, em menor quantidade que a água. A preparação destas soluções aquosas são as mais usadas nos Laboratórios de Química. Existem situações em que se utilizam soluções que não precisam de ter uma concentração rigorosa. Por exemplo, soluções para testes qualitativos. Noutras situações, em que as soluções vão ser usadas em análise quantitativa, a sua concentração tem que ser rigorosamente conhecida (soluções padrão) .
O modo de obtenção de uma solução - padrão é diferente, consoante se trate ou não de uma solução de um padrão primário. As substâncias primárias têm características “pessoais”, de modo que a sua quantidade se pode ficar a saber através de um simples pesagem rigorosa. No caso de se tratar de substâncias não primárias, só será possível saber a quantidade existente num exacto volume de solução desde que se determine, a concentração da referida solução através da fórmula C=n/v
As soluções padrão preparam-se, pesando uma determinada massa de soluto concentrado, dissolvendo-o no solvente e diluindo a solução obtida num balão volumétrico. As soluções mais diluídas, normalmente obtêm-se a partir de soluções mais concentradas: pipetando-se para um balão volumétrico (de volume V1) um determinado volume, V0 , da solução mais concentrada e completa-se o balão com o solvente. Determina-se o factor de diluição (f) a partir da fórmula v1/v0 E não esquecer que numa diluição a quantidade de soluto se mantém constante.
O tiossulfato de sódio (figura 1) é um sal sólido que existe no Laboratório na forma de sal hidratado de fórmula química Na2 S2 O3 5H2 O. É usado como agente fixador-padrão para filmes e papeis fotográficos, na remoção de cloro de águas, têxteis, polpas, na purificação de gases de chaminés, em curtumes de couro, aditivo para lubrificantes de grafite, sabões e champôs.
A solução obtida deste modo não tem uma concentração rigorosa de 0,030 mol/dm-3, visto a substância não ser primária.
Os objectivos desta actividade prática laboratorial são: preparar 50,0 cm3 de uma solução aquosa de tiossulfato de sódio de concentração 0,030 mol/dm-3 e preparar soluções a partir desta com o factor de diluição 5.
Para isso precisei de: seleccionar o material de laboratório adequado á preparação da solução, preparar uma solução de concentração conhecida a partir de um soluto sólido e por diluição de outra, atribuir um significado adequado ao termo “factor de diluição” , e aplicar o conceito de concentração de uma solução.

Figura 1 – Tiossulfato de sódio penta-hidratado

Figura 2 – Balança de Precisão
Figura 3 – Balão Volumétrico
Figura 4 – Pompete
A – Preparação de uma solução aquosa de tiossulfato de sódio de C=0,030 mol/dm-3(figura 5)

Figura 5 – A - Preparação de uma solução aquosa de tiossulfato de sódio de C=0,030 mol/dm-3
B – Preparação de soluções diluídas a partir da solução anterior, com factor de diluição 5. (figura 6)
Figura 6 – B – Preparação de soluções diluídas a partir da solução anterior, com o factor de diluição 5.
|
Soluto |
Massa Molar (M) do soluto |
Concentração Molar a obter da solução |
Quantidade Química (n) do soluto presente na solução |
Massa do soluto (m) a pesar |
|
Na2 S2 O3 5H2 O |
248,22 g/mol |
0,030 |
0,0015 mol |
0,372 g |
Tabela 1 – Tabela de variáveis do Tiossulfato de Sódio penta-hidratado necessárias á solução.
|
Massa de soluto pesado |
Volume da Solução |
Concentração Molar da solução obtida |
| 0,380 g | 0, 050 dm3 | 0,031 mol/dm-3 |
Tabela 2 – Tabela de resultados da Parte A.
| Concentração da solução pipetada (Ci) | Volume da Solução pipetada (Vi) | Volume da Solução Diluída (Vf) | Concentração da solução diluída (Cf) |
| 0,031 mol/dm-3 | 10 mL = 0,010 dm3 | 0,050 dm3 | 0,0062 |
Tabela 3 – Tabela de resultados da Parte B
*os cálculos encontram-se nos Anexos
Os objectivos desta actividade experimental foram alcançados, preparar 50,0 cm3 de uma solução aquosa de tiossulfato de sódio de concentração 0,030 mol/dm-3 e preparar soluções a partir desta com o factor de diluição 5. A concentração da solução diluída é inferior á concentração da solução concentrada, visto que a primeira tem mais água e menos soluto que a segunda. A quantidade química (n) soluto (0,0015 mol) manteve-se em toda a solução visto que numa diluição mantem-se constante. Numa diluição ninicial=nfinal. Pesou-se mais 0,008 g do que o pretendido visto que os grãos de tiossulfato tinha tamanhos variados e era difícil, pesar a quantidade certa.
Anexo 1 – Questões pré Laboratoriais
Determinação da massa molar do tiossulfato de sódio penta hidratado. Determinação da quantidade de soluto (n) na soluça a preparar a partir da definição de concentração C=n/v.
Determinação da quantidade de soluto (n) na soluça a preparar a partir da definição de concentração C=n/v.
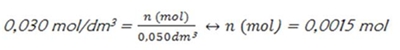 Cálculo da massa do soluto a pesar a partir da relação n=m/M.
Cálculo da massa do soluto a pesar a partir da relação n=m/M.
 Como preparar uma solução, a partir da anterior, com o factor de diluição 2? E factor 2,5? E 5?
Como preparar uma solução, a partir da anterior, com o factor de diluição 2? E factor 2,5? E 5?

Anexo 2 – Questões pós Laboratoriais
Cálculo da concentração da solução preparada em A.
Cálculo da concentração da solução diluída preparada em B.
 Pretende-se preparar 500 cm³ de uma solução aquosa de nitrato de sódio, NaNO3, com concentração 0,010 mol/dm-3 a partir do soluto sólido. Calcule a massa de soluto necessária para preparar esta solução.
Pretende-se preparar 500 cm³ de uma solução aquosa de nitrato de sódio, NaNO3, com concentração 0,010 mol/dm-3 a partir do soluto sólido. Calcule a massa de soluto necessária para preparar esta solução.
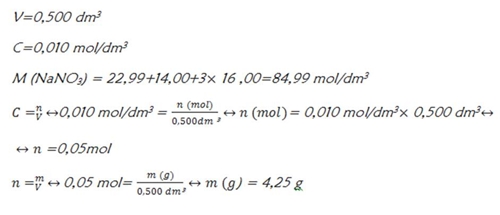 Um aluno transferiu 25,0 cm3 de um solução aquosa de HCl 0,250 mol/dm3 para um balão volumétrico de 100cm3. Adicionou em seguida água destilada até ao traço de referência do balão.
a) Qual a concentração da nova solução?
Um aluno transferiu 25,0 cm3 de um solução aquosa de HCl 0,250 mol/dm3 para um balão volumétrico de 100cm3. Adicionou em seguida água destilada até ao traço de referência do balão.
a) Qual a concentração da nova solução?
 b) Qual o factor de diluição?
b) Qual o factor de diluição?
 Para obter uma solução de 0,0010 mol/dm³ a partir de uma solução 1,00 mol/dm3, qual deve ser o factor de diluição?
Para obter uma solução de 0,0010 mol/dm³ a partir de uma solução 1,00 mol/dm3, qual deve ser o factor de diluição?
 Dilui-se uma solução de KCl de concentração 0,40 mol/dm3 para preparar uma solução mais diluída.
Dilui-se uma solução de KCl de concentração 0,40 mol/dm3 para preparar uma solução mais diluída.
 Que volume de água se deve adicionar a 100 mL de uma solução 1,00mol/L para que fique com uma concentração de 0,250 mol/L? Determine o factor de diluição.
Que volume de água se deve adicionar a 100 mL de uma solução 1,00mol/L para que fique com uma concentração de 0,250 mol/L? Determine o factor de diluição.
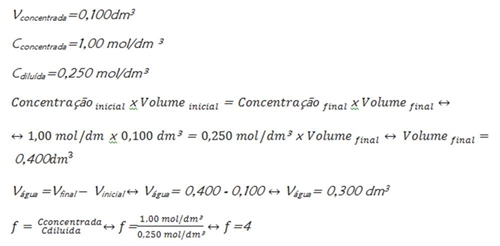
Anexo 3 – Características do tiossulfato de sódio
Identificação de perigo: Produto não perigoso conforme a Directiva 67/548/CEE.
1. Medidas de primeiros socorrosApós a inalação: Exposição ao ar fresco.
Após contacto com a pele: Lavar abundantemente com água. Tirar a roupa contaminada.
Após contacto com os olhos: Enxaguar abundantemente com água, mantendo a pálpebra aberta.
Após ingestão: Beber muita água. Consultar um médico, caso o sinistrado esteja incomodado.
2. Medidas de combate a incêndioMeios adequados de extinção: Adaptar ao meio ambiente.
Riscos especiais: Não combustível. Possibilidade de formação de fumos perigosos em caso de incêndio nas zonas próximas. Em caso de incêndio pode formar-se: óxido de enxofre.
Equipamento especial para combate a incêndio: Permanência na área de perigo com máscara de oxigénio independente do ar ambiente
Outras informações: Precipitar com água os vapores que se libertem. Evitar a infiltração da água de extinção nas águas superficiais ou nas águas subterrâneas.
3. Medidas de controlo de derramamentoMedidas de protecção para as pessoas: Evitar a produção de pós; não inalar os pós.
Método de limpeza / absorção: Absorver em estado seco. Proceder à eliminação de resíduos. Limpeza posterior.
Medidas de protecção do meio ambiente: Não deixar cair para na canalização de águas residuais.
4. Manuseio e armazenamentoManuseio: Sem outras exigências.
Armazenamento: Hermeticamente fechado. Em local seco.
5. Controlo de protecção e protecção individualEquipamento de protecção individual: As características dos meios de protecção para o corpo devem ser seleccionadas em função da concentração e da quantidade das substâncias tóxicas, de acordo com as condições específicas do local de trabalho. A resistência dos meios de protecção aos agentes químicos deve ser esclarecida junto aos fornecedores.
Protecção respiratória: Necessário uso de máscara em caso de formação de pó.
Protecção dos olhos: Necessário uso de óculos de segurança.
Protecção das mãos: Recomenda-se o uso de luvas (material da luva= nitrilo).
Higiene industrial: Mudar imediatamente a roupa contaminada. Depois de terminar o trabalho, lavar as mãos.
6. Propriedades Físico-químicas| Características | |||
| Forma | Sólido | ||
| Cor | Incolor | ||
| Odor | Inodoro | ||
| Valor de pH | 100 g/l em H2O | (20 ºC) | 6,0 - 7,5 |
| Ponto de fusão | 48 ºC | ||
| Ponto de ebulição | não aplicável | ||
| Temperatura de ignição | Não combustível | ||
| Ponto de inflamação | não inflamável | ||
| Limites de explosão | Inferior | não aplicável | |
| Superior | não aplicável | ||
| Densidade | (20°C) | 1,74 | |
| Densidade bruta | ~ 1000 | ||
| Solubilidade em | Água | (20°C) | 701 |
| Decomposição térmica | (100 °C) | 100 °C | |
Condições a serem evitadas: Aquecimento muito forte (decomposição).
Substâncias a serem evitadas: Perigo de explosão em presença de: nitratos, nitritos, compostos peroxidados, oxidantes fortes.
Reacções violentas são possíveis com: flúor, ácidos.
8. Informações ToxicológicaToxicidade aguda: DL50 (oral, rato): > 5000 mg/kg
Outras informações toxicológicas: Não se podem excluir propriedades perigosas. No entanto, são pouco prováveis se a manipulação do produto for adequada.
Livro:
SIMÕES, Teresa Sobrinho, et al, Química em Contexto – Química – Física e Química A 10º ano, Porto Editora, Porto, 2009, páginas 170, 171
Página Web:
FIGURA 1, http://img.alibaba.com/photo/219249354/Sodium_Thiosulphate.jpg, [citado em 16 de Janeiro de 2010]
MAIA Ind. e Com Ltda, Ficha de Segurança, 2007, (revisto em 28/11/2007) [citado em 16 de Janeiro de 2010 ]. Disponível em URL: www.fmaia.com.brFIGURA 2, http://www.chemlab.pt/fotos_artigos/3466Z_EW.jpg, [citado em 16 de Janeiro de 2010]
FIGURA3,http://images.google.pt/imgres?imgurl=http://www.imaculadanet.com.br/images/lab_eq/balao% 2520volumetrico.jpg&imgrefurl=http://guip.tumblr.com/&usg=__ zS85giIByYPV2KCYMdfN925zgy0=&h=350&w=133&sz=22&hl=pt- PT&start=6&sig2=j6pfky8E8w2dGDvGCT6zXg&itbs=1&tbnid=b_vFxWtFK9rroM:&tbnh =120&tbnw=46&prev=/images%3Fq%3D2%2BBALOES%2BVOLUMETRICOS%26gbv% 3D2%26hl%3Dpt-PT&ei=jeBRS7yCBcKA-ga3svS7CA, [citado em 16 de Janeiro de 2010]
FIGURA4,http://images.google.pt/imgres?imgurl=http://www.3tres3.com/tienda/ upload_img/574_4509925.jpg&imgrefurl=http://www.3tres3.com/tienda/index.php %3Fp1%3D2%3D45%26id_prod%3D573&usg=__jjWsjw066YpKnC6LbYXTNnQQPCo =&h=150&w=150&sz=4&hl=pt-PT&start=16&sig2=rxy-kAclm6ihDTeC2cAhrA&itbs= 1&tbnid=V4QJqnescpJaEM:&tbnh=96&tbnw=96&prev=/images%3Fq%3DPIPETA %2BGRADUADA%26gbv%3D2%26hl%3Dpt-PT&ei=zuBRS9uaHZLL-Qb-key0Cw, [citado em 16 de Janeiro de 2010]