
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Ana Silva e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Trabalho escolar sobre a produção de amoníaco (sua importância, aplicações, problemas, etc...), realizado no âmbito da disciplina de Química (11º ano).
No âmbito da disciplina de Físico-Química, foi solicitada a elaboração de um trabalho escrito relativo ao tema: "Produção de amoníaco".
Os assuntos a focar no trabalho seriam:
O amoníaco, gás amoníaco ou amónia é um composto químico cuja molécula é constituída por um átomo de nitrogénio (N) e três átomos de hidrogénio (H) de fórmula NH3.
O amoníaco (NH3) é um gás incolor, irritante, inflamável, tóxico e de odor característico e sufocante, muito solúvel na água. A síntese industrial de amoníaco é feita pelo processo de Haber-Bosch, descoberto devido à necessidade de disponibilizar uma maior quantidade de alimentos com o aumento da população mundial, visto que o amoníaco possuía azoto na sua constituição, elemento essencial ao desenvolvimento das plantas. O amoníaco é principalmente usado na síntese de fertilizantes e de catalisadores, na produção de ácido nítrico e como refrigerante. É obtido a partir do azoto atmosférico e do hidrogénio proveniente do gás natural, segundo a seguinte equação química:
N2(g) + 3 H2(g) → 2 NH3(g)
Existem adubos simples e adubos compostos, sendo que os primeiros os que contêm apenas um elemento fertilizante (azoto, fósforo ou potássio). Os segundos contêm pelo menos dois dos três elementos fertilizantes referidos. Para além disso, existem também os adubos orgânicos, que se obtêm a partir de matéria de origem vegetal ou animal como, por exemplo, a ureia, o estrume e os adubos verdes. Também é componente de vários produtos de limpeza.
O amoníaco é facilmente biodegradável. As plantas absorvem-no com muita facilidade, sendo um nutriente muito importante como fornecedor de nitrogénio. Em concentrações muito altas na água de consumo pode causar danos graves, já que o amoníaco interfere no transporte do oxigénio pela hemoglobina.
O amoníaco é uma matéria-prima importante.
O amoníaco é, nas condições de pressão e temperatura normal (as chamadas condições PTN), um gás incolor, menos denso que o ar. Apresenta cheiro forte e característico, é muito solúvel em água e tem grande aplicação tanto na agricultura, como na indústria. O contacto com o amoníaco no estado gasoso ou em solução aquosa, deve ser evitado, dado que pode provocar lesões graves na pele, nos olhos e nos pulmões.
Trata-se de uma substância constituída por moléculas (substância molecular). Cada molécula contém um átomo de azoto (N) e três átomos de hidrogénio (H), pelo que a fórmula química do amoníaco é NH3.
O azoto e o hidrogénio eram as matérias-primas utilizadas na produção do amoníaco.
O azoto é o gás mais abundante na atmosfera e era obtido através da destilação fraccionada do ar líquido. É gasoso, incolor, inodoro e insípido.
O ciclo do azoto pressupõe que os animais obtenham este elemento através da ingestão de proteínas, quer animais quer vegetais.
O crescimento das plantas requer um constante fornecimento de elementos essenciais à síntese do tecido vivo. De entre esses elementos, os mais importantes são o carbono, o hidrogénio, o oxigénio e o azoto.
A água é o principal fornecedor de hidrogénio.
Poucos organismos são capazes de utilizar o azoto molecular (N2), pois as respectivas moléculas são muito estáveis. Na molécula, os átomos de azoto estão ligados por uma ligação tripla muito forte, com uma elevada energia de ligação, sendo por isso muito difíceis de separar.
Não sendo o azoto molecular directamente utilizável pelas plantas, é necessária a sua conversão numa forma biologicamente utilizável, como os iões nitrato (NO3⁻) e o amoníaco (NH3).

Fig.1- Ciclo do Azoto.
A esta transformação do azoto em compostos azotados biologicamente utilizáveis chama-se fixação do azoto. Na Natureza, a fixação do azoto é feita através de reacções químicas que ocorrem durante as descargas eléctricas na atmosfera. Esta fixação de azoto é também feita por algumas bactérias existentes nos solos e contidas nas raízes de certas plantas, como a soja e o trevo.
Para a maior parte das outras plantas o fornecimento de azoto utilizável tem de vir de outras fontes. Os agricultores enriquecem o solo com azoto sob a forma de nitrato de amónio, ureia ou amoníaco.
Até ao princípio do século XX, as principais fontes naturais dos compostos azotados eram o guano peruano, formado por excrementos de aves marinhas, e o nitrato de sódio ou nitrato do Chile.
No ano de 1900 verificou-se o esgotamento da reserva de guano e tendo em conta o consumo de nitrato de Sódio, este acabaria por rapidamente esgotar também.
Os químicos pensaram em transformar o azoto (que se encontrava na atmosfera), em fertilizante agrícola. O azoto é um composto com baixa reactividade, o que torna a tarefa difícil.
O nitrato de potássio é vulgarmente chamado salitre. O nitrato de sódio é vulgarmente conhecido por nitrato do Chile.

Fig.2- Extracção de Guano.
A substância amoníaco de fórmula NH3, é gasosa à temperatura ambiente e à pressão normal.
O amoníaco tem as seguintes características:
A molécula de amoníaco é formada por um átomo de azoto ligado a três átomos de hidrogénio. Um par de electrões não ligantes no átomo de azoto conduz à geometria piramidal da molécula. O comprimento da ligação N-H é 102pm e o ângulo médio de ligação H-N-H é 107º.

Fig.3- Modelo tridimensional e representação da geometria da molécula de amoníaco (NH3).
O amoníaco produz-se industrialmente usando os gases azoto, N2, e hidrogénio, H2, como matérias-primas. A reacção de síntese do amoníaco é representada pela equação química:
N2 (g) + 3H2 (g) → 2NH3 (g)
Que traduz um dos mais importantes processos industriais da actualidade: o processo de Haber - Bosch.
Em 1909, o químico alemão Fritz Haber (Fig.4) descobriu um processo de produção de amoníaco que veio revolucionar o desenvolvimento da indústria dos fertilizantes.
A Primeira Guerra Mundial foi o grande motor do desenvolvimento das fábricas de amoníaco na Alemanha e noutros países, pois o amoníaco podia ser convertido em ácido nítrico (HNO3), que era utilizado no fabrico de explosivos.
O engenheiro químico Carl Bosh (Fig.5) transformou o processo piloto de Haber num processo industrial capaz de produzir milhares de toneladas de amoníaco por ano.

Fig.4- Fritz Haber. Fig.5- Carl Bosh.
O processo de Haber relaciona o azoto e o hidrogénio através da seguinte equação química:
N₂ (g) + 3H₂ (g) → 2NH₃ (g)
Esta reacção de síntese do amoníaco é muito incompleta quando realizada em condições de pressão e temperatura ambientes. Para ter um rendimento apreciável, tem de se processar a pressão e temperatura elevadas (Pressão = 200 Atm.; Temperatura = 457 º C) e na presença de um catalisador (ferro em pó com pequenas quantidades de óxido de potássio e de óxido de alumínio). Mesmo com estas condições, o rendimento é muito baixo.
As matérias-primas para o fabrico do amoníaco são o gás natural, ou o petróleo, a água e o ar. Como se pode verificar todos estes materiais são de origem natural, ou seja, provêm da natureza.
O hidrogénio pode ser obtido através da reacção entre o gás natural e o vapor de água. Este processo realiza-se em duas fases:
Primeira fase - O gás natural é exposta a vapor de água a altas temperaturas, originando monóxido de carbono e hidrogénio de acordo com a seguinte equação química:
CH₄ (g) + H₂O (g) à CO (g) + 3H₂ (g)
Segunda fase - O monóxido de carbono reage com o vapor de água, originando dióxido de carbono e hidrogénio:
CO (g) + H₂O (g) à CO₂ (g) + H₂ (g)
Do ponto de vista ambiental, este processo de obtenção de hidrogénio não é considerado sustentável devido às emissões de dióxido de carbono que origina e que contribuem para o efeito de estufa. Outra forma de obter hidrogénio é a partir da oxidação parcial de vasta gama de hidrocarbonetos que origina hidrogénio, que é posteriormente purificado. Um dos inconvenientes destes processos de obtenção de hidrogénio é o facto de utilizarem fontes de energia não renováveis.

Fig.6- Produção de hidrogénio a partir de energias renováveis.
A principal fonte de azoto é o ar. No processo de Haber utiliza-se o azoto directamente do ar. Outro processo para obter industrialmente o azoto é a destilação fraccionada do ar líquido. Neste processo o ar é liquefeito e os componentes são separados por destilação fraccionada. Como o azoto é o componente mais volátil, é o primeiro a ser separado.
Como já foi referido este processo de obtenção de NH3 foi desenvolvido por Fritz Haber no ano de 1909. O azoto e o hidrogénio entram num compressor onde são sujeitos a uma pressão elevada. Posteriormente, passam para a câmara de reacção ou conversor, onde se processa a reacção entre o azoto e o hidrogénio a temperaturas elevadas e na presença de um catalisador.
N₂ (g) + 3H₂ (g) à 2NH₃ (g)
Visto esta reacção não ser completa, ficam ainda por reagir grandes quantidades de azoto e de hidrogénio. Por esse motivo, da câmara de reacção sai uma mistura de amoníaco (NH₃) com azoto e hidrogénio. Esta mistura entra no condensador, onde o amoníaco se liquefaz e é recolhido. Por fim, o azoto e o hidrogénio que não reagiram são novamente introduzidos no conversor através de uma bomba de reciclagem.
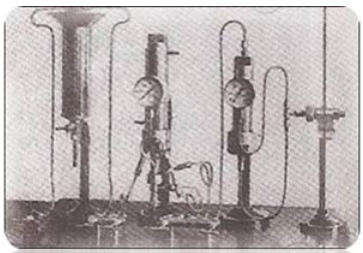
Fig.7- Aparelho de Haber para a síntese do amoníaco.
Grande parte do amoníaco é utilizado na produção de fertilizantes azotados, mas também tem um grande contributo na produção de ácido nítrico, um dos principais ácidos inorgânicos. O amoníaco é ainda usado na produção de corantes, medicamentos, explosivos e detergentes.

Fig.8- Produtos amoniacais.
O facto de haver uma grande absorção de energia sob a forma de calor do exterior torna a vaporização do amoníaco (passagem do estado líquido para o gasoso) um processo muito endotérmico, produzindo arrefecimento nos materiais envolventes. Consequentemente o amoníaco líquido é utilizado como meio de arrefecimento em muitas indústrias alimentares.

Fig.9- O amoníaco utilizado nas diversas indústrias tem inúmeras aplicações.
O Amoníaco é uma substância muito útil nos processos de refrigeração devido ao seu elevado calor de vaporização e de temperatura crítica, sendo assim muito utilizado em circuitos frigoríficos à mais de um século, em máquinas de compreensão mecânica de potência média e grande e em máquinas frigoríficas de pequenas potências, como por exemplo, refrigeradores e frigoríficos domésticos.
Como fluído usado na refrigeração, o amoníaco apresenta numerosas características e vantagens, tais como:
A utilização do amoníaco pode envolver riscos directos e indirectos para a saúde dependendo do tempo de exposição e/ou da sua concentração. Riscos directos param a saúde:
A complicação imediata a recear é o edema da glote.

Fig.10- Dermatose. Fig.11- Conjuntivite.
A presença de amoníaco pode causar modificações do pH nos sistemas ecológicos aquosos visto a solução aquosa de amoníaco ser uma base. A decomposição térmica do amoníaco origina óxidos de azoto, que são agentes poluentes da atmosfera, pois dão origem às chuvas ácidas.
O amoníaco que é libertado para a atmosfera, pode originar sulfato de amoníaco e nitrato de amoníaco, aos quais se dá o nome de matérias particulares, que são partículas de características sólidas ou líquidas, que se encontram dispersas pela atmosfera. As maiorias das partículas, que têm um diâmetro superior a 5mm, depositam-se no nariz, na traqueia e nos brônquios, mas quanto mais pequena for a dimensão destas partículas mais perigosas as mesmas se tornam (depositam-se em zonas de maior risco).

Fig.12- Efeitos das Chuvas Ácidas.
Os efeitos na saúde provocados por uma exposição prolongada a estas matérias, em partículas, são:
Na produção de amoníaco, do processo de obtenção de matérias-primas para o fabrico deste, ocorre a produção de dióxido de carbono como um subproduto, que ao ser lançado para a atmosfera vai ser um dos contribuintes para o fenómeno do efeito de estufa. (Fig.13)

Fig.13- Efeito de Estufa.
Antes de transportar os recipientes:

Fig.14- Amoníaco.
Investigar e calcular a quantidade de matérias-primas necessárias, para obter 200 toneladas de amoníaco, tendo em conta os rendimentos das reacções.
N2(g)+3H2(g) → 2NH3(g)
Rendimento = ?
200 Toneladas de NH3 = n real
1 Tonelada – 1000 kg
200 Toneladas – x
x = 200 x 1000/ 1 = 200 000 kg
1 Grama – 0.001 kg
x - 200 000 kg
x = 1 x 200 000/0.001 = 200 000 000 Gramas = 2x10^8 Gramas
M (NH3)= 14+1x3= 17 g/mol
M (H2)= 1x2= 1 g/mol
2x17= 34g/mol 3x1= 3g/mol
2 mol de NH3 – 3 mol de H2
2x10^8 Gramas – x
x = 2x10^8 x 3/34 = 1.76x10^9 g de H2
Rendimento= n real/ n teórico x 100 %
Após a investigação, o rendimento é aproximadamente 50%.
50%= 2x10^8/ n teórico x 100%
50% x 2x10^8 = n teórico x 100%
1x10^10 = n teórico x 100%
1x10^10/100% = n teórico
n teórico = 1x10^8 mol
O amoníaco é um composto muito útil para limpar nódoas de:
É possível produzir amoníaco em casa!
Para produzir amoníaco é necessário uma gama de materiais e compostos indispensáveis, tais como:

Fig.15 – Experiência.
Com este trabalho tivemos conhecimento que o amoníaco é muito importante para a sociedade actual, lembrando que é muito importante para os agricultores que enriquecem o solo com azoto sob a forma de nitrato de amónio, ureia ou amoníaco.
A substância amoníaco de fórmula NH3, é gasosa à temperatura ambiente e à pressão normal e produz-se industrialmente usando os gases azoto, N2, e hidrogénio, H2, como matérias-primas. A reacção de síntese do amoníaco é representada pela equação química:
N2 (g) + 3H2 (g) → 2NH3 (g)
Haber e Bosch tiveram o mérito de desenvolver a produção industrial do amoníaco com base no azoto existente na atmosfera. Durante anos, estudaram as melhores condições de temperatura e pressão para a reacção de síntese do amoníaco.
As matérias-primas para o fabrico do amoníaco são o gás natural, ou o petróleo, a água e o ar.
O amoníaco é, também, utilizado na produção de ácido nítrico, um dos principais ácidos inorgânicos. Além de ser uma das matérias-primas da indústria dos fertilizantes, este ácido é, ainda, usado na produção de corantes, medicamentos e explosivos.
O amoníaco é um gás incolor, irritante, inflamável, tóxico e de odor penetrante e, dependendo do tempo de exposição e/ou da sua concentração, a utilização do amoníaco pode envolver riscos directos e indirectos para a saúde.
A solução aquosa de amoníaco é uma base; como tal, a presença de amoníaco pode causar modificações nos sistemas ecológicos aquosos.
A decomposição térmica do amoníaco origina óxidos de azoto, que são agentes poluentes da atmosfera, pois não dão origem às chuvas ácidas.
O amoníaco libertado para a atmosfera pode dar origem a sulfato de amónio e a nitrato de amónio, considerados matérias particuladas - partículas sólidas ou líquidas dispersas na atmosfera. O amoníaco constitui a matéria-prima de um número elevado de indústrias portuguesas: utiliza-se no fabrico de vários fertilizantes agrícolas, de fibras, de plásticos, de produtos de limpeza, de explosivos, entre outros.
O transporte deve ser evitado em veículos onde o espaço de carga não é separado do compartimento do condutor. Deve-se assegurar, também, que o condutor do veículo conhece os perigos potenciais da carga, bem como as medidas a tomar em caso de acidentes ou emergências. Em caso de acidente devem-se ter em conta várias regras de primeiros socorros bem como de medidas em caso de fugas acidentais.