
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Sara Pinho e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Trabalho escolar (Relatório) sobre o funcionamento de um sistema tampão, realizado no âmbito da disciplina de Química (12º ano).
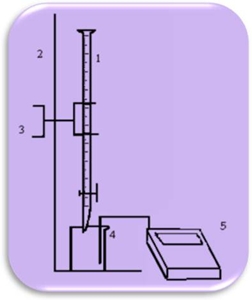
Legenda
Fig.1 Titulação base fraca/ácido forte. Adição de HCl a Na2CO3, com o auxílio do medidor de pH.
O processo de titulação consiste numa reacção de neutralização que ocorre entre um ácido e uma base dando origem a um sal e água, traduzindo-se na reacção genérica: ácido + base ¾¾® sal + água. Assim, a titulação, ou volumetria de ácido-base, é uma técnica de análise quantitativa que consiste na determinação da concentração de uma solução (titulado) através da sua reacção com outra solução de concentração conhecida (titulante).
Com a actividade prática realizada pretendeu-se determinar a concentração de uma solução aquosa de Na2CO3, por titulação de uma base fraca com um ácido forte (solução-padrão de HCl). Neste tipo de titulações (base fraca/ácido forte ou vice-versa) há uma fase, antes do ponto de equivalência, em que acréscimos consideráveis de titulante provocam variações de pH diminutas tratando-se então de um efeito tampão.
O estudo destas soluções assume actualmente um papel preponderante em áreas de interesse biológico. Por exemplo, os tampões CO2/HCO3- e H2PO4-/HPO42- são deveras importantes para a manutenção do pH do sangue e dos líquidos intracelulares, respectivamente.
Posteriormente, pretendeu-se igualmente traçar a curva de titulação para cada um dos ensaios determinando-se assim o pH no ponto de equivalência e identificando as zonas com efeito tampão.
A detecção do ponto de equivalência determina-se adicionando, gradualmente, pequenas quantidades do titulante ao titulado, até a reacção química entre as suas soluções ser praticamente completa. É nesse momento que se diz que se atingiu o ponto de equivalência da titulação embora o que seja realmente detectado é o ponto final através da variação brusca de uma propriedade física ou química do titulado. Esta detecção visual é possível através da mudança de cor de uma substância adicionada, designada por indicador.
Nesta actividade experimental utilizámos a fenolftaleína e o alaranjado de metilo cujos valores da zona de viragem são os seguintes:
Zona de Viragem (pH)
Fenolftaleína – 8.2 a 10
Alaranjado de metilo – 3.2 a 4.4
Por outro lado, também um medidor de pH pode ser usado para determinar o ponto de equivalência. Deste modo, na actividade prática realizada aliámos estes dois processos. Neste segundo caso, é necessário ter em atenção o manuseamento do equipamento bem como a leitura dos valores, atendendo à sensibilidade do aparelho.
Com os valores de pH recolhidos para cada volume de titulante adicionado, traçou-se as curvas de titulação para cada um dos ensaios. Para determinar o ponto de equivalência que se situa na zona de viragem dos respectivos indicadores, usou-se o método das tangentes. Este processo consiste em:
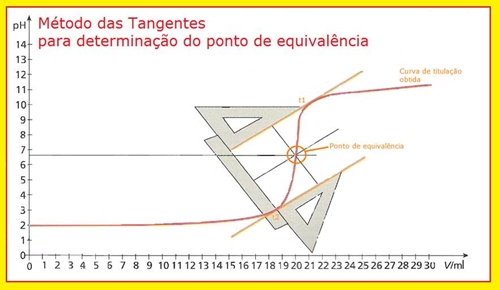
Fig.2 Determinação gráfica do ponto de equivalência.
Relativamente aos reagentes, utilizámos como titulante ácido clorídrico e, como base, uma solução de carbonato de sódio.
Importante é também referir que, aquando da concretização desta actividade experimental, certos cuidado deverão ser tomados em conta evitando discrepâncias falaciosas, como seja a eliminação de bolhas de ar, respeitar os algarismos significativos ou o simples facto de fazer as leituras dos aparelhos correctamente, atendendo à sua sensibilidade.
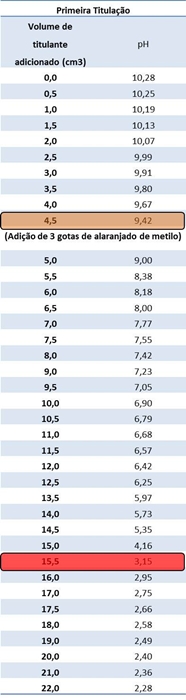
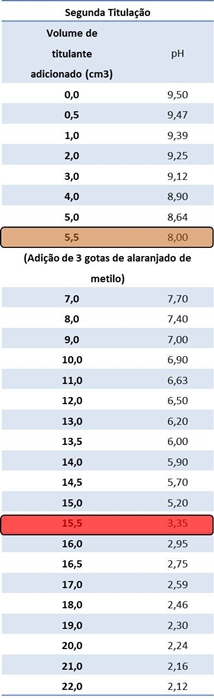
Tabelas I e II: Resultados obtidos relativamente à primeira e segunda titulação, respectivamente.

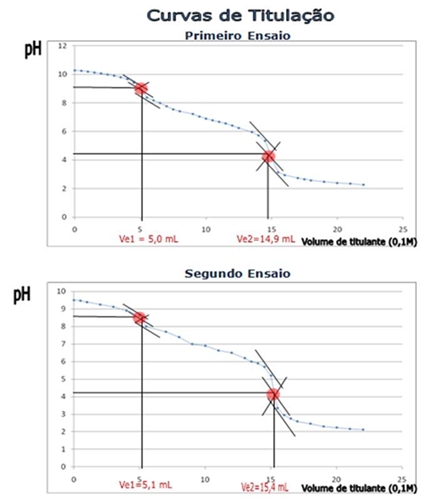
Gráficos I e II: Curvas de titulação correspondentes à primeira e segunda titulação, respectivamente
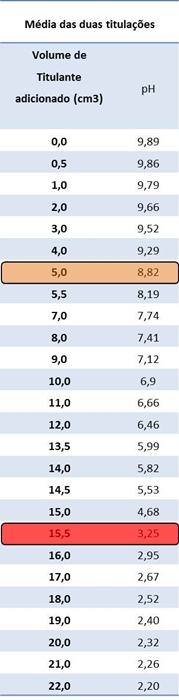
Tabela III: Média dos resultados obtidos relativamente à primeira e segunda titulação, realizadas, respectivamente.
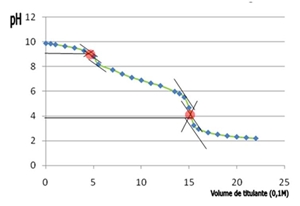
Gráfico III: Curva de titulação correspondente à média dos valores obtidos nas duas titulações
Sabemos que, na presença de água, o ácido clorídrico se comporta do seguinte modo:
HCl (aq) + H2O (l) ¾® H3O+ (aq) + Cl-(aq), sendo que o ião cloreto é um ião espectador já que é uma base conjugada de um ácido muito forte.
Por sua vez, a equação respeitante à dissociação do carbonato de sódio é a seguinte:
Na2CO3 (aq) ¾H2O® 2 Na+ (aq)+ CO32- (aq)
O Na+ é um ácido conjugado de uma base muito forte, pelo que, tal como o cloreto, se vai comportar como um ião espectador. Deste modo, é o ião CO32- que vai reagir com o ácido clorídrico:
Numa primeira fase, dá-se a conversão do carbonato em hidrogenocarbonato:
H3O+(aq) + CO32- (aq) ¾® HCO3-(aq) + H2O (l) (quando em proporções estequiométricas, dá-se o primeiro ponto de equivalência)
Numa segunda fase, dá-se a conversão do hidrogenocarbonato em ácido carbónico:
H3O+(aq) + HCO3-(aq) ¾® H2CO3 (aq) + H2O (l) (quando em proporções estequiométricas, dá-se o segundo ponto de equivalência)
Por sua vez, para calcular a concentração da solução de carbonato de sódio, utiliza-se a seguinte expressão válida no ponto de equilíbrio da reacção:
na=nb
logo, ca x Va = cb x Vb
Para tal, temos os seguintes dados:
Cácido = 0,10M
Vácido = volume de titulante adicionado
cbase = ?
Vbase = 0,10 cm3
Para cada ensaio, os resultados obtidos estão expressos na tabela seguinte:
| Primeiro Ensaio | Segundo Ensaio |
|
|
Tabela IV: Cálculo da concentração da solução de carbonato de sódio através dos pontos de equivalência de cada titulação.
O primeiro ponto de equivalência para o primeiro e segundo ensaios correspondeu a um pH de 9,1 e 8,6, respectivamente, os quais são superiores ao valor esperado (8,3). Também no segundo ponto de equivalência, os valores obtidos para o pH da solução (4,2 e 4,1) são superiores ao esperado (3,7).
Relativamente à concentração calculada para a solução de carbonato de sódio há discrepâncias em relação aos valores esperados, mas não entre os dois ensaios.
Assim, fazendo os cálculos, a concentração calculada da solução de Na2CO3, foi de 0,15 mol.dm-3, um valor ligeiramente superior ao teórico (0,10 mol.dm-3)
Os ensaios foram realizados a uma temperatura aproximada de 18ºC, pelo que, de certa forma poderá justificar que os resultados obtidos não sejam exactamente iguais ao previsto.
Um aspecto também a mencionar é que o volume gasto para atingir o segundo ponto de equivalência deveria ter sido sensivelmente o mesmo que o primeiro, o que não aconteceu.
Deste modo, pode-se afirmar que ocorreu um erro no cálculo do primeiro ponto de equivalência que terá tido origem em incorrectos registos de valores para o volume de titulante ou ainda da leitura incorrecta do gráfico obtido o que é menos provável. Também a pureza dos reagentes pode ser posta em causa.
NOTA: Na realização desta actividade laboratorial foi necessário tomar especial cuidado no manuseamento do ácido clorídrico visto que este em contacto com a pele poder causar irritação cutânea.
Através da análise dos gráficos de titulação é possível concluir que as zonas com efeito tampão são: no gráfico I, correspondentes aos intervalos 0 a 4, 7 a 14 e 16 a 22 de volume de titulante adicionado; no gráfico II, correspondentes aos intervalos 0 a 5, 6 a 14 e 17 a 22 de volume de titulante adicionado; no gráfico III, correspondentes aos intervalos 0 a 4, 7 a 14 e 16 a 22 de volume de titulante adicionado; nestas zonas existe igual quantidade de Na2CO3 e de um sal do seu ácido conjugado, nas proporções estequiométricas.
Pode-se igualmente concluir que os indicadores utilizados foram os mais indicados já que a zona de viragem contém o valor do pH para o ponto de equivalência o que, atendendo ao erro de titulação, nos permitiu confirmar que foi naquela altura e para aquele volume que se atingiram as proporções estequiométricas de cada uma das reacções em cima referidas.
Apesar de discrepâncias em relação aos valores inicialmente esperados, estas que se devem à ocorrência de erros experimentais sistemáticos como sejam incorrectas leituras, medições ou variações ambientais como a temperatura que condiciona a extensão da reacção, conclui-se que a concentração da solução de carbonato de sódio é de 0,15 mol.dm-3.