
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Daniela Ferreira e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Trabalho (Relatório) cujo objectivo foi aplicar um conjunto de processos químicos e físicos integrantes de um ciclo de cobre, realizado no âmbito da disciplina de Química (12º ano).
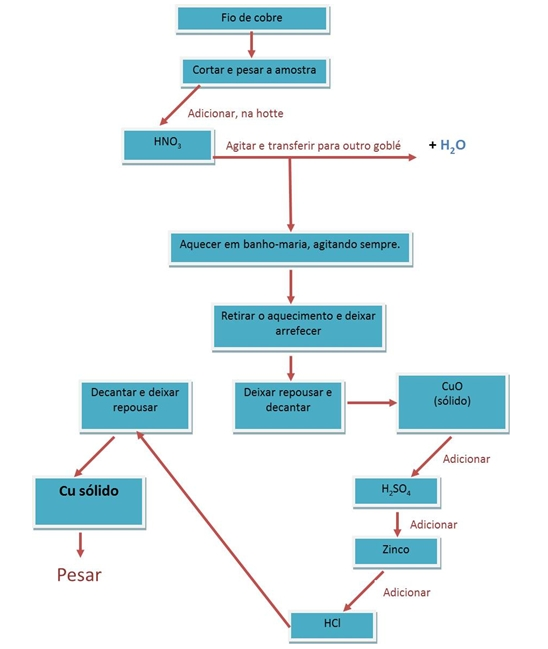
O ciclo de cobre é uma sequência de reacções sucessivas que permitem recuperar o metal inicial (cobre), ou seja, são sequências que têm como inicio e fim o cobre.
O objectivo do trabalho é fazer com que nós, alunos, apliquemos um conjunto de processos químicos e físicos integrantes de um ciclo de cobre.
Temos também como objectivo, caracterizar a reactividade dos elementos metálicos, nomeadamente do cobre; reconhecer a importância da reciclagem dos metais em geral e identificar alguns problemas de poluição relacionados com a reciclagem do cobre.
O problema proposto nesta actividade laboratorial foi “Será possível reciclar uma substância usando processos químicos com rendimento de 100%?”. Tendo em conta esse problema, devemos ver de que depende o rendimento dessa experiência e ver se é possível obter um rendimento com esse valor.
O cobre é um elemento químico de símbolo Cu (do latim Cuprum) e tem número atómico 29. É considerado um metal de transição estando localizado no grupo 11, 4º período, bloco d da tabela periódica.

É um dos metais mais importantes industrialmente e á temperatura ambiente encontra-se no estado sólido. Tem uma coloração avermelhada, é dúctil, maleável e bom condutor de electricidade. Em solução aquosa apresenta-se normalmente comoCu(H2O)2+ (embora também forme catiões monopositivos) e tem uma cor azul-cobalto característica. O óxido de cobre (II), formado quando o cobre é aquecido em presença de oxigénio, tem cor negra.
Tal como os outros metais, o cobre apresenta uma baixa energia de ionização, logo um elevado poder redutor.
Actualmente é utilizado essencialmente para a produção de materiais condutores de electricidade, como fios e cabos, e em ligas metálicas, como latão e bronze.
O ciclo de cobre é um conjunto de reacções que começam numa liga de cobre para formar cobre puro, que possa ser utilizado novamente. É por isso um processo de reciclagem de cobre. (1)
Ciclo de cobre
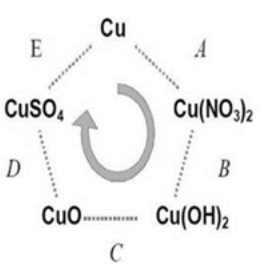
As reacções observadas ao longo do ciclo de cobre são:
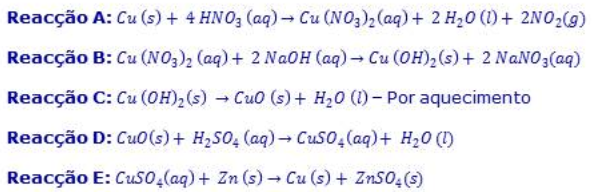
As reacções acima referidas são reacções de oxidação – redução. Este tipo de reacções ocorre quando ocorrem transferências de electrões. Neste tipo de reacções existem dois tipos de substâncias – o oxidante e o redutor. Oxidante é a espécie química que, numa reacção química, capta electrões, isto é, é reduzida, provocando a oxidação da outra espécie. O oxidante é o aceitador de electrões. Redutor é a espécie química que, numa reacção química, cede electrões, isto é, é oxidada, provocando a redução da outra espécie química. O redutor é o dador de electrões.
Também ocorrem reacções ácido-base e reacções de precipitação. As primeiras são reacções entre soluções aquosas ácidas e soluções aquosas básicas. Nessas reacções forma-se sempre uma substância pertencente à categoria dos sais e ainda água. As últimas, reacções de precipitação, são processos químicos em que um dos produtos da reacção forma pequenas partículas sólidas que ficam em suspensão no seio de uma solução (precipitado). Esse sal é muito pouco solúvel, ou seja, com baixa solubilidade.
Assim sendo, as reacções A e E são de oxidação – redução; a reacção D é reacção ácido base, a reacção B é uma reacção de precipitação e a reacção C é uma reacção de composição por calor. (7)
Todas as reacções são exotérmicas. Reacções exotérmicas são reacções que transferem energia para o exterior, sob a forma de calor, num sistema fechado que, então, fornece energia às suas vizinhanças. Tratando-se de um sistema isolado, a temperatura do sistema aumenta durante a reacção até ser atingido o equilíbrio. Isto é, aumenta o grau de agitação atómico - molecular.
Utilizamos também a Lei de Lavoisier. Segundo esta lei, nas reacções químicas em sistema fechado, a soma total das massas das espécies envolvidas na reacção (reagentes) é igual à soma total das massas das substâncias produzidas pela reacção (produtos de reacção), ou seja, num sistema químico fechado em reacção, a massa total permanece constante. Esta lei também pode ser enunciada da seguinte forma: "Na Natureza nada se cria e nada se perde, tudo se transforma".
O rendimento, h , de uma reacção química está relacionado com a quantidade de produto obtido relativamente à quantidade de reagente limitante consumido, apresentando uma reacção um rendimento de máximo, 100 %, sempre que todo o reagente limitante se transforma em produto, o que corresponde a uma reacção completa. Sempre que tal não acontece, reacção incompleta, o rendimento da reacção é inferior a 100%.
![]()
Nesta actividade prática laboratorial, realizamos uma decantação. Decantação é um método de separação pouco rigoroso entre uma fase sólida e uma fase líquida ou entre duas fases líquidas. Esta separação realiza-se devido à diferença de tamanho ou peso das partículas pelo efeito de uma corrente lenta de água ou ar. Para separar uma fase sólida de uma fase líquida, deixa-se a mistura em repouso para que o sólido se deposite no fundo do recipiente - sedimentação. O líquido sobrenadante é então transferido, lenta e cuidadosamente, para outro recipiente, evitando-se que o sólido venha arrastado. Deve realizar-se uma decantação sempre que a fase sólida tenha dimensões apreciáveis e só depois proceder a uma filtração. Para separar duas fases líquidas, a mistura é colocada numa ampola ou num funil de decantação, retirando-se a fase mais densa pela parte inferior da referida ampola.
Durante esta actividade laboratorial falamos também de reciclagem de metais. Os metais são materiais de elevada durabilidade, resistência mecânica e facilidade de conformação, sendo muito utilizados em equipamentos, estruturas e embalagens em geral. Quanto à sua composição, os metais são classificados em dois grandes grupos: os ferrosos (compostos basicamente de ferro e aço) e os não-ferrosos. Essa divisão justifica-se devido à grande predominância do uso dos metais à base de ferro, principalmente o aço. Entre os metais não-ferrosos, destacam-se o alumínio, o cobre e as suas ligas (como o latão e o bronze), o chumbo, o níquel e o zinco. Os dois últimos, junto como o cromo e o estanho, são mais utilizados na forma de ligas com outros metais, ou como revestimento depositado sobre metais, como, por exemplo, o aço.
A grande vantagem da reciclagem de metais é evitar as despesas da fase de redução do minério a metal. Essa fase envolve um alto consumo de energia, e requer transporte de grandes volumes de minério e instalações caras, destinadas à produção em grande escala.
Regra geral, todos os materiais metálicos usados podem ser recuperados e novamente fundidos. É bem conhecida a reciclagem da sucata de ferro, que se processa nas siderurgias. As embalagens metálicas, principalmente as de alumínio, seguem o mesmo procedimento, podendo ser recicladas nas siderurgias ou nas fundições de alumínio. A reciclagem dos metais a partir de objectos usados contribui fortemente para a poupança de recursos naturais (minérios) e permite grande redução de gastos energéticos. (10)
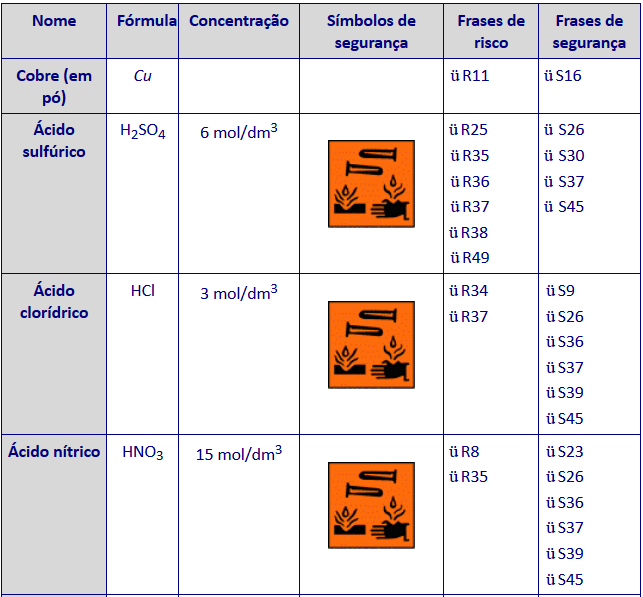
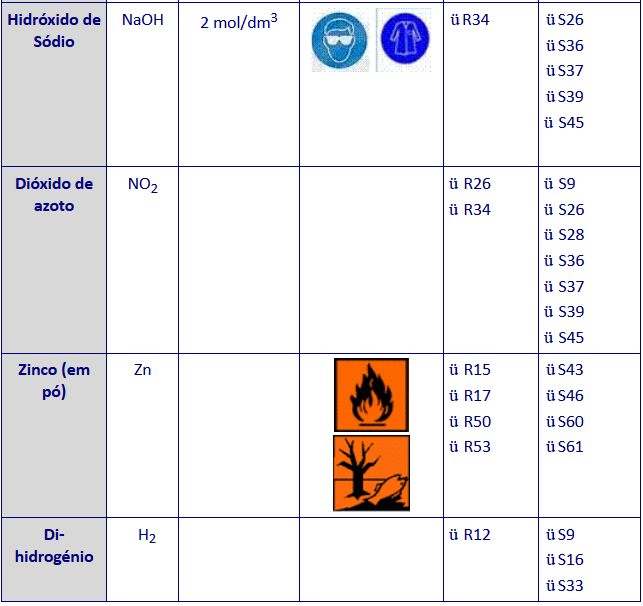
* Seguem em anexo as frases de risco e de segurança abordadas na tabela acima descrita.
1. Cortamos um fio de cobre de modo a obter uma amostra com cerca de 0,3g;
2. Pesamos a amostra e registamos o valor da massa efectivamente medida.
3. Colocamos o fio no fundo de um goblé.
![]()
4. Na hotte, adicionamos 5 mL de HNO3 concentrado. Agitamos suavemente até a dissolução estar completa. Observamos e registamos as alterações.
![]()
5. À solução de Cu(HO3)2 adicionamos a solução de NaHO 3 mol/dm3 (V= 30,0mL) e agitamos com uma vareta de vidro para precipitar Cu(HO)2 até não haver formação de mais precipitado. Registamos todas as observações.
![]()
6. Aquecemos, quase até à ebulição, a solução contida no goblé, agitando sempre para uniformizar o seu aquecimento.
7. Após a reacção estar completa e retiramos o aquecimento.
8. Deixamos repousar o sólido formado e retiramos, com cuidado, o líquido sobrenadante por decantação. Lavamos o sólido com 3-4mL de água desionizada, agitamos e decantamos uma vez mais.
![]()
9. Adicionamos, ao sólido, cuidadosamente e gota a gota, a solução de H2SO4 6 mol/dm3, até dissolver todo o sólido. Registamos as alterações.
![]()
10. No goblé, adicionamos, de uma só vez, cerca de 1,3g de zinco em pó, agitando até o líquido sobrenadante ter ficado incolor (adicionamos mais um pouco de zinco de modo a transformar todos os iões de cobre (Cu2+) contidos na solução em cobre sólido.) Registamos as alterações.
11. Para eliminar a possível existência Zn por reagir, adicionamos, gota a gota a solução de HCl 3 mol/dm3. Agitamos e deixamos repousar.
12. Quando não observamos mais libertação de gás, decantamos o líquido. Lavamos com cerca de 3-4mL de água desionizada, deixamos repousar e decantamos o líquido. Repetimos este procedimento, pelo menos, mais duas vezes.
13. Colocamos o gobelé com o sólido a secar à temperatura ambiente durante alguns dias (o ideal era utilizar uma estufa, controlando, assim, a temperatura).
14. Pesamos novamente e registamos para posterior cálculo do rendimento.
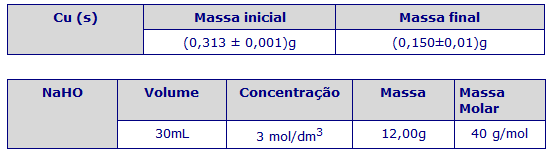
Massa de zinco adicionada = 1,41g + 1,19g + 1,99g + x (massa adicionada pelo professor sem medição)
|
Reacções |
Observações |
| Reacção A | . A solução inicialmente era esverdeada. . Ao adicionar o HNO3, libertou-se um gás em tons de vermelho/castanho, causando uma certa efervescência ( causada pela libertação de gases). . O cobre começou a diluir-se e a perder massa. . O goblé ficou castanho, enquanto que a solução ficou verde, e libertou um odor forte. . A dissolução foi demorada. . Mais tarde (após a dissolução), a solução ficou em tons de azul, deixando de haver libertação de gases; o goblé perdeu a cor castanha. . Após adicionarmos água, a solução ficou mais clara, libertando vapores incolores. A concentração da solução diminuiu. . Obs: esta reacção foi realizada na hotte para evitar possíveis acidentes e também porque houve libertação de gases, razão pela qual as paredes do gobelé escureceram. (2) |
| Reacção B | . Libertou-se vapor de água. . A solução ficou com uma tonalidade azul mais intensa e aquece. . Formou-se um precipitado azul escuro. . Após agitar formou-se uma solução homogénea azul-escura e ficaram resíduos nas paredes do goblé. |
| Reacção C | . A solução começou a escurecer e acabou por ficar verde escura. Passados uns minutos ficou negra e ficaram resíduos nas paredes do goblé. . Após o aquecimento, deixou-se repousar e ficaram partículas em suspensão formando-se um precipitado no fundo do goblé. . Na primeira decantação foi removida a água resultante do aquecimento. (3) |
| Reacção D | . Libertou-se um fumo branco e a solução ficou azul novamente (a cor do cobre em iões é azul). . A solução aqueceu. |
| Reacção E | . A solução ficou azul (ou seja, ainda tem iões de cobre). . Adicionamos mais zinco. . Libertou-se vapor de água até se obter cobre na forma sólida. . A solução aqueceu. . O cobre, após algum tempo, pousou no fundo do goblé. . A realização da reacção E levou à libertação de uma pequena quantidade de gás incolor que, apesar de não estar incluído na equação química que traduz a reacção, concluímos ser Hidrogénio. (4) |
![]()
Oxidação
Nºs de oxidação: 0 +1, +5, -2 +2, +4 , -2 +1, -2 +4, -2
Redução
Podemos considerar esta reacção como sendo de oxidação - redução, pois há alteração dos números de oxidação dos reagentes para os produtos.
![]()
Nºs de oxidação: +2, +5, -2 +1, -2, +1 +2, -2, +1 +1, +5, -2
Esta reacção é de precipitação, pois pode observar-se o aparecimento de um precipitado sólido. Não pode ser considerada de oxidação – redução pois os números de oxidação não variam dos reagentes para os produtos.
![]()
Nºs de oxidação: +2 , -2, +1 +2, -2 +1, -2
Esta reacção não pode ser considerada redox pois não há alteração dos números de oxidação. Pode considerar-se uma reacção de decomposição por calor.
![]()
Nºs de oxidação: +2 , -2 +1, +6, -2 +2, +6, -2 +1, -2
Esta reacção não é redox, pois os números de oxidação permanecem iguais dos reagentes para os produtos. É uma reacção ácido – base pois há formação de água.
![]()
Nºs oxidação: +2, +6, -2 0 0 +2 , +6, -2
Redução Oxidação
Esta reacção é de oxidação – redução pois o nº de oxidação de Cu passa de +2 para 0 e o número de oxidação do Zn passa de 0 para +2, ou seja, há variação dos números de oxidação.



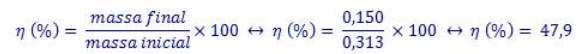
O rendimento obtido foi de 47,9%, um valor que é um pouco abaixo do que seria de esperar. Este valor pode ser explicado pelas decantações que foram realizadas: a primeira com o objectivo de remover a solução de NaNO3 , a segunda para remover a solução de sulfato de zinco e a terceira para remover o HCl e zinco presentes. Estas podem conduzir a perdas de produto devido à falta de precisão. Outro factor que poderá estar associado ao baixo rendimento será o facto de algum cobre ter ficado alojado nas paredes do goblé. Podem também ter ocorrido erros nas medições de massas devido à má calibração das balanças ou erros acidentais. (9)
Todas as reacções que envolveram manuseamento de ácidos foram realizadas na hotte com o objectivo de evitar possíveis acidentes.
Ao longo do procedimento verificaram-se mudanças de cor nas soluções. Essas alterações advêm das reacções observadas. Quando o cobre reagiu com o ácido nítrico (oxidando-se) a sua tonalidade mudou para verde libertando-se o gás NO2. Quando ficou totalmente oxidado, a sua cor tornou-se azul. Quando ocorreu um aquecimento, surgiu um precipitado de óxido de cobre (de cor negra) e um líquido sobrenadante (incolor). Na altura em que se juntou ácido clorídrico ao precipitado, o cobre foi novamente dissolvido e voltou à cor azul. Já o líquido sobrenadante adquiriu uma cor acastanhada.
No procedimento, não foi necessário proceder à lavagem do cobre, pois este estava envolvido em plástico, não estando por isso oxidado.
É necessário recolher o líquido sobrenadante como resíduo no passo 11 (ZnSO4), pois tem interesse económico e é prejudicial para o ambiente. (5)
Com esta actividade laboratorial pudemos perceber que a reciclagem do cobre poderá acarretar alguns malefícios ambientais. Dado que o cobre é um metal muito reactivo, em contacto com ácidos liberta certos gases que podem prejudicar o ambiente. Apesar destas contrapartidas, a sua reciclagem é fácil e económica, o que a torna uma prática comum. (11)
Para que o ambiente seja protegido, é necessário promover a reutilização de metais como o cobre, que em contacto com certas substâncias possam trazer danos para o ambiente.
As reacções observadas ao longo do ciclo de cobre são:

O Cu, é oxidado pelo ácido nítrico, libertando-se óxido de azoto, de cor acastanhada.

A esta solução é adicionado hidróxido de sódio, que causa a precipitação do cobre (como hidróxido de cobre).

Este precipitado, quando aquecido, na presença de oxigénio, decompõe-se, originando óxido de cobre.

Ao óxido de cobre é depois adicionado acido sulfúrico, dissolvendo-se o óxido de cobre e formando-se sulfato de cobre, numa reacção ácido base.

O sulfato de cobre é posteriormente reduzido pelo Zn, que tem maior poder redutor, numa reacção redox.
No final da actividade laboratorial, poderíamos ter provado que o sólido recolhido no final era cobre através do teste da chama. Os testes da chama têm por base o aquecimento de uma amostra sólida. Está técnica é utilizada para identificar o ião positivo existente num sal puro. Os iões negativos presentes, em geral, não interferem nesta análise. Quando os sais são aquecidos, os electrões dos átomos podem ser excitados, ocorrendo então uma absorção de energia. Os electrões regressam depois ao estado fundamental, com a consequente libertação dessa energia sob a forma de uma chama colorida. Alguns elementos emitem radiação na região visível sendo possível, em alguns casos, identificar a presença desses elementos através da coloração que conferem à chama. No caso do cobre, a coloração seria azul ou verde. (8)
Ao longo deste relatório, as respostas às questões pós laboratoriais estão assinaladas com o número da questão dentro de parênteses.