Home » Secundário » 10º Ano » Física e Química » Teste da Chama (Atividade Laboratorial)
Teste da Chama (Atividade Laboratorial)
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Tatiana Rodrigues e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Resumo do trabalho
Atividade laboratorial:
Teste de chama
Objetivos:
Com a realização desta atividade experimental pretende-se identificar elementos químicos em amostras de sais usando testes de chama.
Material/Reagentes:
- 4 Vidros de relógio
- Bico de bunsen
- Ansas
- Proveta
- Fósforos
- 4 espátulas
- Álcool
- Vidro azul de cobalto
- Redes de difração
- Espetroscópio
- Etanol
- Cloreto de cobre
- Cloreto de potássio
- Cloreto de lítio
- Cloreto de sódio
Esquema de montagem: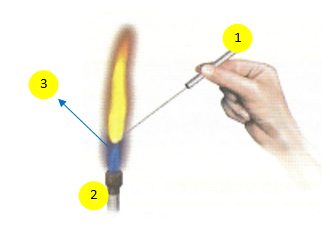
- Ansa de cromo e níquel
- Bico de bunsen
- Amostra de sal
Cuidados a ter / regras de segurança:
- Deve ser usado o bico de bunsen em vez de uma lamparina de álcool pois o primeiro produz uma chama mais quente, ou seja com mais energia, o que se traduz numa maior transição, podendo assim observar o espetro com uma maior nitidez; o orifício do bico de bunsen deve permanecer aberto durante o teste de chama de forma a ter um maior contacto com o oxigénio, e consequentemente uma chama mais quente formando uma combustão completa.
- Deve ser usada uma ansa de cromo e níquel, pois esta quando incandescente não emite radiações na zona do visível, não contaminando a amostra de sal a ser analisada;
- Verificar se os vidros de relógio estão bem limpos e secos;
- As ansas de cromo e níquel devem ser limpas entre cada ensaio, para retirar resíduos das análises anteriores;
- O teste de chama apresenta limitações quando a chama é observada à vista desarmada. Se o sal que está a ser analisado – por exemplo, um sal de potássio - contiver catiões sódio, a chama amarela de sódio sobrepõe-se à chama violeta de potássio. Para evitar esta situação, deve olhar-se para a chama através de vidro azul de cobalto, que absorve a luz amarela;
- O sódio deve ser o último a ser utilizado porque é um agente muito contaminante, pois possui um espetro muito nítido ao contrário dos outros sais utilizados;
- Nunca cheirar ou provar diretamente os produtos químicos.
- O etanol é uma substância inflamável, devendo ser mantido afastada das chamas;
- O ácido clorídrico é uma substância corrosiva, devendo usar-se bata e luvas de proteção.

Registo de dados e observações:
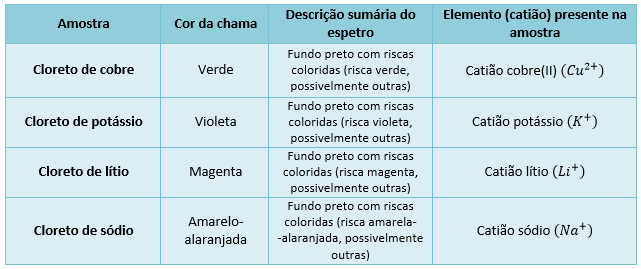

Tratamento dos dados experimentais/ Resultados obtidos:
Para desenvolvermos os dados experimentais é necessário possuir alguns conhecimentos sobre o tema a desenvolver nesta atividade, dos quais estão referidos na próxima página.
- Quando sais no estado sólido, ou em solução, são sujeitos a elevadas temperaturas, emitem radiações de cores características sob a forma de chama colorida (zona do visível);
- A cor da chama é característica do elemento e permite uma identificação prévia. Contudo, essa identificação só fica completa quando se analisa essa chama com um espetroscópio, de modo a comparar o espetro obtido com espetros de referência.
- A cor da chama que vemos diz respeito a juncão de todas as radiações emitidas por esse sal no processo de desexcitação dos eletrões;
- Durante o teste de chama, os vários sais a analisar têm de possuir em comum o anião ( anião cloreto ) de forma a controlar a sua influência;
- As diferentes cores das chamas resultantes da queima de vários sais de cloro, devem-se à emissão da radiação visível pelos diferentes catiões dos sais, uma vez que o anião é o mesmo;
- Os catiões metálicos, quando sujeitos a elevadas temperaturas, atingem estados excitados e, ao voltarem, espontaneamente, a estados de menor energia, emitem a energia absorvida sob a forma de radiação, observando-se assim uma chama colorida característica de cada catião. O conjunto das radiações emitidas corresponde ao espetro do elemento em causa.
De seguida encontram-se os espetros teóricos, que correspondem parcialmente aos que foram observados, com o espetroscópio de bolso, durante a aula experimental:
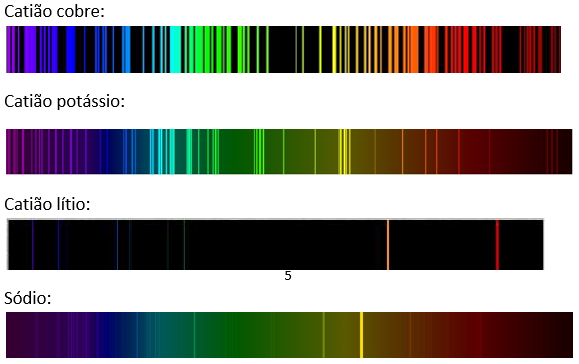
Alguns dos possíveis motivos que serão responsáveis por não observarmos os espetros dos elementos presentes nos sais das amostras exatamente como os espetros teóricos, poderão ser a contaminação de alguns sais provenientes de uma má limpeza das ansas de cromo e níquel, uma má visualização dos espetros através da rede de difração, entre outros.
Análise e crítica dos resultados obtidos:
Como já foi referido anteriormente no tópico sobre os cuidados a ter durante a atividade laboratorial, o teste de chama apresenta limitações quando a chama é observada a olho nu, usando-se o vidro de cobalto para evitar uma possível discrepância. Podemos também afirmar que os espetros observados correspondem aos espetros teóricos de cada um dos elementos presentes nos sais analisados.
Conclusão:
Depois de realizar a atividade e de efetuar a análise dos resultados obtidos verifica-se um comprimento do objetivo. Identificou-se, usando o teste de chama, elementos químicos em amostras de sais.
Bibliografia:
Caderno de atividades laboratoriais; novo JOGO DE PARTÍCULAS; Física e Química A; Química A – 10.º Ano
347 Visualizações
13/06/2019






