
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Filipa Timóteo e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Trabalho escolar sobre titulação potenciométrica, realizado no âmbito da disciplina de Química (12º ano).
A atividade laboratorial realizada na disciplina de monitorização ambiental teve como objetivo a determinação da concentração exata de soluções previamente preparadas sendo elas, hidróxido de potássio, ácido clorídrico e  ácido acético, recorrendo, assim, a uma titulação potenciométrica.
ácido acético, recorrendo, assim, a uma titulação potenciométrica.
Existem várias formas de realizar uma titulação e vários tipos de titulações, neste trabalho experimental realizou-se uma titulação potenciométrica ácido/base.
A titulação é um dos processos mais utilizados em química analítica quantitativa. É uma técnica volumétrica em que através da medição rigorosa de volumes é possível determinar a concentração de uma solução, utilizando outra solução cuja concentração é conhecida (solução padrão).
Neste processo adiciona-se uma solução, que é colocada na bureta (titulante), à outra solução que se encontra no balão de Erlenmeyer (titulado) ocorrendo entre as duas, uma reação ácido-base.
O ponto de equivalência da reação é atingido quando o número de mol de iões H3O+, provenientes do ácido, iguala o número de mol de iões OH- provenientes da base. Do ponto de vista prático, a deteção do ponto de equivalência pode ser feita usando um indicador ácido-base apropriado, que, mudando de cor para um valor de pH, o mais próximo possível do ponto de equivalência, assinala o fim da titulação. No entanto, existem outros processos de deteção deste ponto, como o uso de um medidor de pH (método potenciométrico) ou a medição da condutividade elétrica do titulado (método condutimétrico).
No método potenciométrico recorre-se a um elétrodo, sendo que no trabalho em questão o elétrodo utilizado foi um elétrodo combinado que contém um elétrodo de vidro e um elétrodo de referência de calomelano saturado combinados numa única unidade, formando uma peça de equipamento que é mais robusta para se introduzir e suportar na solução a ensaiar. O princípio no uso deste elétrodo está, basicamente, na sua membrana de vidro. Quando esta é imersa numa determinada solução, desenvolve-se um potencial que é uma função linear da concentração de hidrogénio na mesma.
Substancia primária: Para que seja possível a determinação da concentração exata de uma substância em solução, sem ser necessário recorrer a titulações ou outros processos, é necessário que essa mesma substância obedeça a certos critérios, sendo eles:
Além destas condições, deve-se ainda escolher as substâncias de maior massa molecular, pois isso diminui o erro relativo cometido na pesagem, aumentando assim a precisão da análise. As substâncias que satisfazem as condições acima mencionadas são designadas substâncias primárias. Estas substâncias normalmente são utilizadas na titulação de soluções em que a sua concentração exata é desconhecida.
Iniciou-se o trabalho prático pela realização de cálculos necessários à preparação das soluções a titular. O objetivo principal do trabalho era a titulação de uma base forte com um ácido forte, assim como a titulação da mesma base forte com um ácido fraco. A base escolhida foi o hidróxido de potássio, porém esta solução não sendo uma substancia primária necessita de ser previamente titulada com uma outra solução de concentração exata conhecida. Após a preparação de hidrogeno ftalato de potássio (substância primária) e titulação da solução de KHO, procedeu-se à titulação das soluções ácidas.
Para realizar estas titulações é necessário pipetar 15,00 mL de cada solução ácida para um gobelé de 100 mL, juntando 5 gotas de indicador, e preparar uma bureta com KHO padronizado. É também essencial efetuar a calibração e condicionação dos eléctrodos presentes no titulador potenciométrico com soluções tampão de pH 4 e 7. Depois da preparação do material inicia-se a titulação, em que se mede o pH da solução titulada após adições sucessivas de 1 mL de titulante.
Aquando do fim da titulação traçam-se os gráficos da curva de titulação, e determinam-se os pontos finais, calculando, desta forma, a concentração rigorosa das soluções.
V = 200,00 mL
M (C8O4H5K) = 204,22 g/mol
[C8O4H5K] = 0,1 mol/L
[C8O4H5K] = n/v ⇔ n = 200,00 × 10-3 × 0,1 ⇔ n = 0,020
m = n × M
mteórica = 0,020 × 204,22 ⇔ m = 5g C8H5O4K
mpesada = 5,1505g
n = 5,1505 / 204,22 ⇔ n= 0,02522 mol
[C8O4H5K] = 0,02522 / 200,00 × 10-3 ⇔ [C8O4H5K] = 0,12610 mol/L
[KHO] = 0,1mol/L
V = 250,00 mL
%m/m = 85%
n= [KHO] × V ⇔ n= 0,1 × 250,00 ⇔ n = 0,025 mol
m= 0,025 × 56,11 ⇔ m= 1,4g KHO
1,4g →→→ 85%
x →→→→ 100% x=1,6g KHO
M (CH3COOH) = 60,06 g/mol
[CH3COOH] = 0,1 mol/L
r = 1,05 g/ml
V = 200,00 mL
n = 0,1 × 200,00 × 10-3 ⇔ n= 0,02 mol
m = 0,02 × 60,06 ⇔ m = 1,20g
V = m/p ⇔ V= 1,20/1,05 ⇔ V= 1,14 mL CH3COOH
Nota: não foram necessários cálculos para a preparação da solução de HCL, pois esta já se encontrava preparada.
KHO - C8O4H5K KHO- CH3COOH KHO-HCL
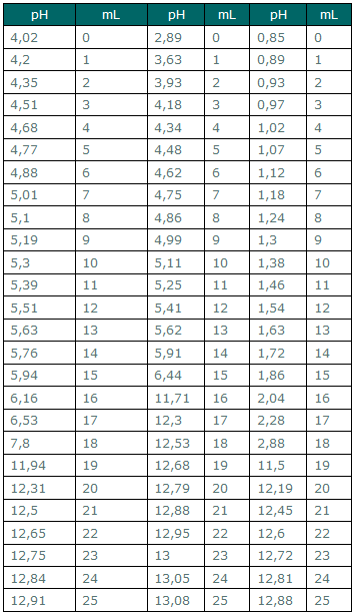

Veq = 18mL
V C8O4H5K = 15,0 mL
KHO(aq) + C8O4H5K(aq) → C8O4H5K2(aq) + H20 (l)
[C8O4H5K] = 0,12610 mol/L
n(C4H5O2K) = n (KHO)
n= 0,12610 × 15,00 × 10-3 ⇔ n= 1,892 × 10-3 mol
[KHO] = 0,1051 mol/L

Veq.=16 mL
VCH3COOH = 15 mL
CH3COOH (aq) + KHO (aq) -> CH3COOK (aq) + H2O(l)
[KHO] = n/v ⇔0,1051 = n / (16,00 × 10-3) ⇔ 1,682 × 10-3 molKHO [CH3COOH] = n/v ⇔(1,682 × 10-3)/(15,00 × 10-3) = 0,1121 mol/L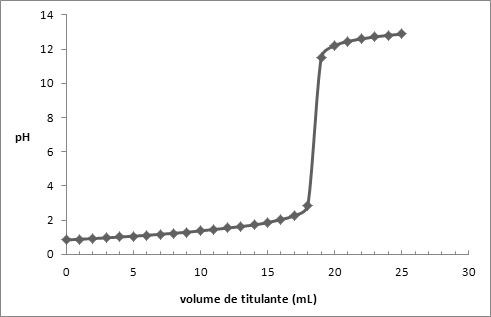
Veq. = 18,2 mL
VHCl = 15 mL
KHO(aq) + HCL (aq) → KCL (aq) + H2O (aq)
[KHO] = n/v ⇔ 0,1051 = n/(18,20 × 10-3) ⇔ 1,9128 × 10-3 molKHO [HCl] = n/v ⇔(1,9128 × 10-3)/(15,00 × 10-3) = 0,1275 mol/LAtravés deste trabalho prático foi possível determinar a concentração exata de todas as soluções preparadas através das titulações realizadas. O tipo de titulação que se realizou foi uma titulação potenciométrica, para tal recorreu-se ao titulador potenciométrico presente no laboratório.
É possível concluir que o trabalho correu como planeado, o único obstáculo encontrado foi apenas a leitura das instruções de calibração, visto que se encontravam em francês. No entanto, não foram sentidas outras quaisquer dificuldades.
Assim, a concentração das soluções foram as seguintes: