
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Beatriz Bocinhas e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Relatório de Atividade Experimental sobre a oxidação de um prego, realizado no âmbito da disciplina de Biologia (12º ano).
O material e o procedimento encontram-se de acordo com a ficha de trabalho dada pela professora. Resultados
Tabela de resultado obtidos:
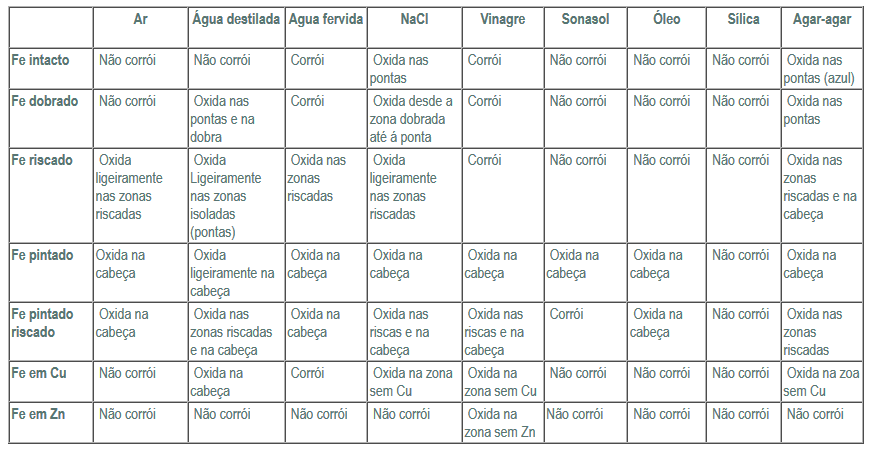
Tabela de resultado esperados:
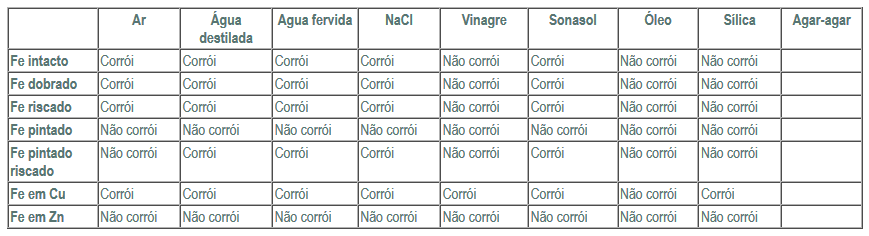 Discussão
DiscussãoOs principais agentes responsáveis pela formação de ferrugem são a água e o oxigénio. No entanto existem vários métodos de proteger os metais contra a corrosão, e de entre os quais se destacam: camada protectora, como a pintura ou plastificação; protecção anódica; galvanização; protecção catódica.
O primeiro método de protecção acima referido consiste em aplicar uma camada protectora, como pintura ou plastificação, no metal que se pretende proteger. Por exemplo, quando pretendemos proteger um determinado metal da corrosão, quando este se encontra num solução de água salgada, pode-se recorrer á pintura, plastificação, protecção anódica ou catódica. Foi o que podemos observar na nossa experiência, uma vez que nos pregos protegidos com uma camada de tinta só se verificou corrosão nas pontas deste (uma vez que não se encontravam pintadas). Os pregos pintados e os pregos pintado riscado, contidos na solução de sílica não oxidaram. No prego pintado e riscado houve corrosão nas zonas riscadas, porque houve uma fissura do material protector. Estes resultados estão de acordo com os resultados esperados.
Na protecção anódica, o metal é intencionalmente oxidado, para que se forme na sua superfície uma camada fina e aderente de óxido. Essa camada protectora protege o metal do contacto com o oxigénio e com a água.
Outro tipo de protecção é a protecção catódica, que consiste num processo de protecção do metal, em que o ferro é posto em contacto com um outro metal fortemente redutor (magnésio ou zinco). Esses metais vão funcionar como ânodo da reacção e o ferro como cátodo. Este tipo de protecção é muito utilizado em canalizações, oleodutos e navios.
Um dos factores que pode também influenciar a corrosão dos metais é a temperatura, uma vez que o seu aumento faz aumentar também o nível de oxidação do metal. Temos o exemplo do Titanic, que após tantos anos não apresenta o nível de corrosão esperado pelos cientistas. Uma possível explicação, além da protecção anódica e catódica, será o efeito da temperatura. Uma vez que a temperatura aumenta, aumenta também o nível de corrosão do metal, logo se o Titanic se encontra naufragado numa zona da Terra muito fria, no meio do gelo, metal de que é feito o barco não oxida. Outra hipótese será o nível de oxigénio presente no fundo do mar, uma vez que quanto menor for a sua concentração menor é o nível e a rapidez de corrosão do ferro. Dado que o nível de oxigénio no fundo do mar é reduzido, a corrosão do barco será mínima.
No decorrer da experiência observamos que os pregos intactos só oxidaram na presença de água fervida, NaCl (nas pontas), vinagre e Agar-agar (também só nas pontas, verificando-se uma coloração azul). Este facto, da coloração azul nas pontas do prego, é devido á presença de hexacianoferrato (III) de potássio que confere cor azul da Prússia no local da oxidação, indicando também a presença de iões Fe2+. O ferro intacto quando exposto ao ar, devia de se oxidar, uma vez que o oxigénio é um dos principais agente corrosivos. Tal não aconteceu talvez devido ao tempo insuficiente de exposição do prego ao ar.
Em relação aos pregos dobrados, estes sofreram oxidação nas zonas dobradas, na presença de água destilada, água fervida, NaCl, vinagre e Agar-agar, uma vez que ao ser dobrado, o prego ficou na sua superfície com falhas, aumentando a probabilidade de oxidação.
Relativamente ao prego riscado este oxidou, na presença de ar, água destilada, água fervida, NaCl, e Agar-agar. Esta oxidação deve-se ao facto de ao se riscar o prego, danificou-se a sua superfície facilitando também a oxidação. Estes resultados encontram-se em parte de acordo com os resultados esperados.
Os pregos enrolados com fio de cobre e de zinco, apenas oxidaram nas zonas não cobertas por cobre e zinco. Os pregos enrolados em Cu, oxidaram com água destilada, água fervida, NaCl, vinagre, e Agar-agar. Este facto deve-se ao potencial normal de redução do Cu ser maior do que o potencial normal de redução do Fe, logo o cobre não sofre corrosão, oxidando-se o ferro. Em relação ao ferro enrolado com fio de zinco, este só oxidou com vinagre. Neste caso o ferro só oxidou nas zonas sem zinco, uma vez que o seu potencial normal de redução é maior do que o potencial normal de redução do zinco.
Em relação é diferença entre o ferro e o aço a nível de oxidação considera-se o ferro mais sujeito á corrosão, uma vez que o aço é uma liga metálica constituída por ferro e carbono. Assim as ligações do ferro que se podiam oxidar estão ocupadas por carbono. De notar também que no processo de corrosão de uma determinada peça metálica a reacção de oxidação pode ocorrer num ponto distante do ponto onde ocorre a redução.
Podemos observar e concluir através da realização da experiência, que a sílica desempenhou um papel importante, uma vez que todos os pregos em contacto com esta não se oxidaram, tal como previsto, dado que esta absorve a humidade impedindo a corrosão.
Um dos factores que também influencia bastante a corrosão é a variação de pH. Esta influencia não é igual para todos os metais. No caso particular do ferro, a rapidez da corrosão aumenta tanto para valores muito altos, como para valores muito altos. Este não é praticamente corroído no intervalo de 4 a 12.
Através da realização desta actividade experimental podemos concluir que:
Material: O mesmo utilizado na nossa actividade experimental.
Procedimento: Algumas alterações no procedimento da actividade experimental feita: