
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Ana Anastácio e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Trabalho escolar sobre o átomo de hidrogénio e a estrutura atómica, realizado no âmbito da disciplina de Física (10º ano)...
Para obter espectros atómicos é necessário provocar a excitação dos átomos no estado gasoso, o que se pode fazer por meio de uma descarga eléctrica através de um gás rarefeito contido num tubo de Plucker ou por aquecimento de um sal na chama do bico de gás.
Os átomos assim excitados perdem rapidamente esse excesso de energia sob a forma de radiação, que pode ser observada na zona do visível, como é o caso do espectro do átomo de hidrogénio (uma risca vermelha, uma azul e duas violetas)

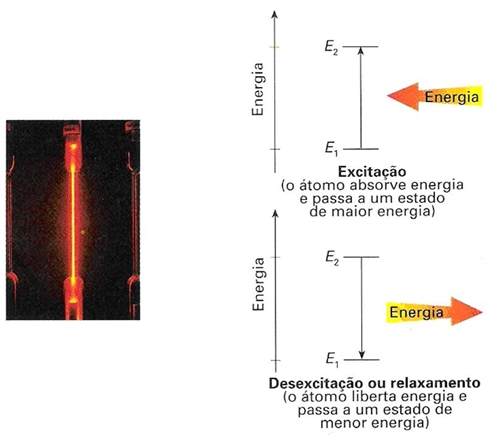
Bohr baseou-se nos estudos de Planck-Einstein sobre a descontinuidade da energia para interpretar e tirar conclusões sobre a observação deste espectro: se só aparecem determinadas riscas no espectro, isto é, se só são emitidos pelo átomo algumas radiações de determinada energia, então, dentro do átomo, o electrão só pode ter certas energias e não todas. Ou seja, só alguns estados de energia são permitidos para o electrão no átomo – são chamados estados estacionários de energia.
A descontinuidade das riscas espectrais está associada à descontinuidade da energia do electrão no átomo.
Ao observar e interpretar o espectro atómico e descontínuo do átomo de hidrogénio, Bohr formulou o seu modelo para o átomo de hidrogénio, admitindo que:

O valor da energia absorvida ou emitida pelo electrão é igual à diferença energética entre os níveis superiores e inferiores.
Eradiação = Esuperior – Einferior
Cada risca espectral é o resultado da passagem do electrão de um nível superior para um nível inferior, com simultânea emissão de um fotão de energia
Esuperior – Einferior .
A existência de um espectro de emissão de riscas mostra que, no átomo de hidrogénio, só existem certos níveis de energia bem definidos (quantização da energia), entre os quais se dão as transições electrónicas que conduzem às riscas espectrais observadas
 Bohr determinou os valores das energias para os diferentes níveis possíveis através da expressão teórica que deduziu com base nas leis da mecânica clássica :
Bohr determinou os valores das energias para os diferentes níveis possíveis através da expressão teórica que deduziu com base nas leis da mecânica clássica :
Os valores referidos no diagrama estão também em concordância com os obtidos por via experimental ou seja a partir do espectro
Da análise do diagrama pode concluir-se:
Exercício:
A partir do diagrama, calcule a energia mínima necessária para arrancar o electrão ao átomo de hidrogénio, no estado fundamental. Qual a designação do valor encontrado. (energia de ionização é a energia mínima necessária para arrancar o electrão mais energético de um átomo quando este se encontra no estado fundamental)
Para além das riscas espectrais visíveis há um conjunto de riscas na zona do ultravioleta e outros conjuntos na  zona do infravermelho.
zona do infravermelho.
Série de Lyman é formada por um conjunto de radiações UV correspondentes às transições electrónicas de níveis superiores para o nível 1.
Série de Balmer é formada por um conjunto de radiações visíveis correspondentes às transições electrónicas de níveis superiores para o nível 2
Série de Paschen é formada por um conjunto de radiações IV correspondentes às transições electrónicas de níveis superiores para o nível 3
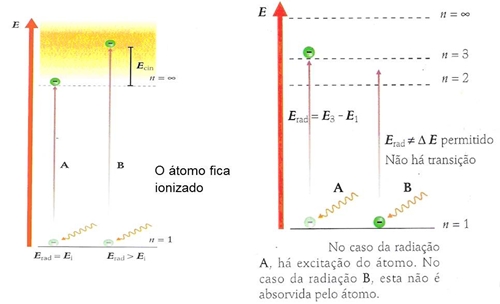
Quando sobre um átomo incide energia sob a forma de radiação, pode ocorrer três situações:
Efinal = Einicial+ E radiação absorvida
Um modelo atómico não é mais do que uma tentativa de explicar aquilo que não se vê mas que se encontra de acordo com os factos num dado momento do conhecimento cientifico.
Defendeu a ideia de que a matéria era composta por pequeníssimas partículas.

Átomo Demócrito (460 – 370 A.C.)
Modelo proposto por Demócrito:

Aristóteles (384 a.C. - 322 a.C.)
Modelo de Demócrito foi rejeitado por um dos maiores filósofos de todos os tempos–Aristóteles.
Aristóteles acreditava que a matéria era contínua e composta por quatro elementos:

O Modelo de Demócrito permaneceu na sombra durante mais de 20 séculos...

John Dalton (1776 – 1844)
Séc. XIX – Dalton “ressuscita” A Teoria Atómica
Na segunda metade do séc. XVIII, a Química sofreu uma grande evolução.
Certos factos não podiam ser explicados pela teoria de Aristóteles, como a Lei de Lavoisier: “A massa dos reagentes é igual à massa dos produtos”.
Para explicar estes factos Jonh Dalton propôs, em 1807, o seu modelo atómico.
Modelo proposto por Dalton:
A matéria é composta por pequenos corpúsculos, indivisíveis – os Átomos;

 J. J. Thomson (1856 - 1940)
J. J. Thomson (1856 - 1940)
Thomson realizou uma série de experiências utilizando um tubo de raios catódicos (tubo semelhante aos tubos existentes no interior dos televisores).
Neste tubo, eram efectuadas descargas eléctricas através de um gás rarefeito.

Tubo de raios catódicos
Em 1897 Thomson propõe novo modelo:
Ao estudar as descargas no interior deste aparelho, Thomson, descobriu o electrão.

Observava-se uma fluorescência esverdeada devido à existência de partículas de carga negativa que saem dos átomos do cátodo.
A descarga emitida tinha carga eléctrica negativa e era de natureza corpuscular.
A sua massa era muito menor que a massa de qualquer átomo conhecido – eram os electrões.
Thomson provou que os electrões eram corpúsculos, dotados de carga eléctrica e de massa, que fazem parte de toda a matéria.
O átomo era uma esfera maciça de carga eléctrica positiva, estando os electrões dispersos na esfera.
O número de electrões seria tal que a carga total do átomo seria zero.
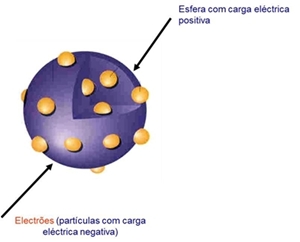
Modelo de Pudim de Passas

Ernest Rutherford (1871 - 1937)
Cientista neozelandês, estudou com J.J. Thomson.
Em 1908 realizou uma experiência que lhe permitiu propor um novo modelo atómico.
Resultados previstos segundo o modelo de Thomson:
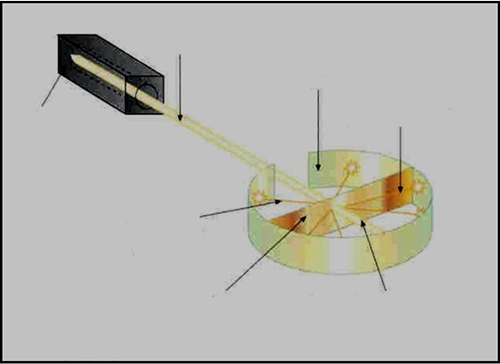
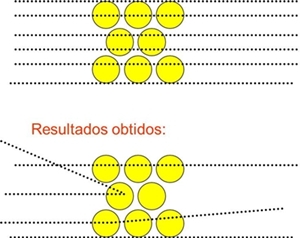
As partículas α deveriam atravessar as folhas de ouro sem sofrer desvios.
A maior parte das partículas α comportava-se como esperado, mas um significativo número delas sofria desvios acentuados

Embora a maior parte das partículas se comportasse como esperado, uma parte significativa não só foi desviada, como algumas voltaram para trás.
Existe, no interior do átomo, uma região central positiva – o núcleo, que exerce fortes forças repulsivas sobre as partículas alfa.
O átomo é uma estrutura praticamente vazia, e não uma esfera maciça;
É constituído por:
Núcleo muito pequeno com a carga positiva, onde se concentra quase toda a massa do átomo.
Electrões com carga negativa movendo-se em volta do núcleo.
O átomo seria um sistema semelhante ao sistema solar. Modelo Planetário
Apenas algumas órbitas seriam permitidas aos electrões;
Cada órbita correspondia a um nível de energia bem definido do electrão;
Os electrões podem saltar de uma órbita para outra, ao absorver ou emitir energia.
O nível mais energético seria o mais distante do núcleo, e o menos energético o mais próximo.
Mas este modelo era incompatível com algumas das teorias da Física ...

De acordo com a física clássica, o electrão ao realizar a sua órbita perderia energia acabando por cair sobre o núcleo, destruindo o átomo.
Rutherford não colocava restrições à energia do electrão no átomo. O seu modelo falhava na interpretação dos espectros atómicos descontínuos.

Niels Bohr (1885 - 1962)
Niels Bohr trabalhou com Thomson, e posteriormente com Rutherford.
Tendo continuado o trabalho destes dois físicos, aperfeiçoou, em 1913, o modelo atómico de Rutherford.
Modelo proposto por Bohr :

Também este modelo apresentava algumas falhas...
No entanto, ainda é o modelo mental utilizado por muitos cientistas, visto ser de fácil visualização.

Erwin Schrödinger (1887 – 1961)
Por volta de 1927, os cientistas deixaram de acreditar que o electrão teria uma trajectória bem definida em torno do núcleo.
Schrödinger propôs o modelo da Nuvem electrónica
Nuvem electrónica...

órbita orbital
Abandonou-se o conceito de órbita e passou-se a falar em orbital.
Orbital é a região do espaço atómico onde há probabilidade encontrar o electrão com uma dada energia.
O modelo de Bohr estava errado ao afirmar que os electrões se deslocam em órbitas circulares em volta do núcleo.
Modelo da Nuvem Electrónica ou modelo quântico do átomo
Entende-se por comportamento do electrão todas as energias possíveis para o electrão e a sua probabilidade de presença à volta do núcleo, ou seja, as orbitais possíveis.
Pode assumir valores inteiros 1,2,3,…
Cada valor de n indica o nível de energia ou camada.
Nota: este nº quântico já aparecia no modelo de Bohr.
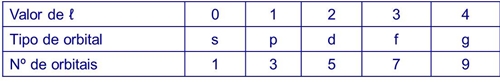
Número quântico de momento angular, secundário ou azimutal (ℓ) – relacionado com a forma da orbital (tipo de orbital)
Pode assumir valores inteiros desde zero até n -1
Refere-se aos subníveis de energia dentro do mesmo nível. São representados por letras ou números
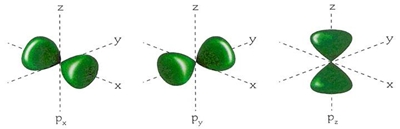
A orbital s tem forma esférica.

As orbital p tem forma de lóbulo com três orientações possíveis
Número quântico magnético ( mℓ)
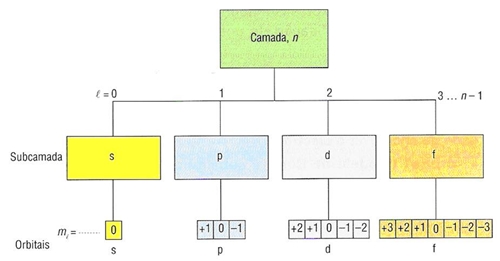
Número e tipo de orbitais em cada nível

Para caracterizar o electrão são necessários 4 nº quânticos
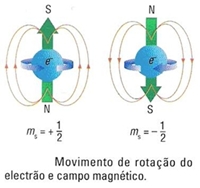
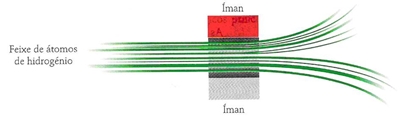
O feixe de átomos dividiu-se em dois na presença de um íman, o que permite concluir que os ímanes que os electrões representam têm duas orientações opostas correspondentes a dois estados de spins opostos.
Exercício
Escreva os conjuntos de números quânticos possíveis para os electrões da orbital 1s
Resolução: (n, ℓ, ml, ms)
(1, 0, 0, +1/2) e (1, 0, 0,-1/2)
Conclusão: numa orbital pode existir no máximo dois electrões com spins opostos. Esta afirmação é conhecida pelo principio de Exclusão de Pauli.
Nota:
Para cada n há no máximo n2 orbitais e 2n2 electrões
Para cada ℓ há (2 ℓ + 1) orbitais e 2(2 ℓ +1) electrões

. Em partículas monoelectrónicas
A energia das orbitais só depende do número quântico principal.
Quanto maior for o nº quântico principal (n) maior é a energia da orbital.
. Em átomos polielectrónicos
A energia das orbitais depende do nº quântico principal n e do nº quântico secundário ℓ
Nota: No diagrama as orbitais são representadas por caixas
. Um conjunto de orbitais com o mesmo valor de n é designado por nível de energia ou camada.
. Para um dado valor de n, um conjunto de orbitais com o mesmo valor de ℓ é designado por subnível de energia ou subcamada.
exemplo: n=2 ℓ =0 - subnível s
ℓ =1 - subnível p
. Uma orbital 3s com dois electrões representa-se por
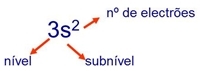
Por vezes é conveniente representar cada orbital por uma caixa e cada electrão por uma
Exemplo: ![]() vrepresenta uma orbital com dois electrões.
vrepresenta uma orbital com dois electrões.
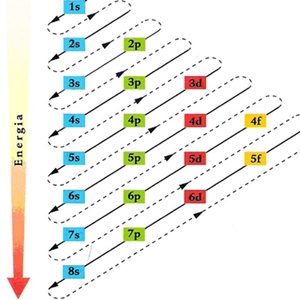
Diagrama de Linus Pauling
Configuração electrónica é distribuição dos electrões pelas orbitais, obedecendo:
Regra de Hund - num conjunto de orbitais com a mesma energia, coloca-se primeiro um electrão em cada uma delas com spins paralelos e só depois se faz o emparelhamento.
Exemplo:
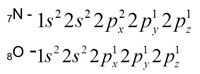
Para átomos de elementos com nº atómico mais elevado pode simplificar-se a configuração electrónica representando-se os electrões do cerne pela configuração electrónica do gás nobre do período anterior da T.P., seguida dos electrões de valência.
Exemplo: 20Ca: [Ar] 4s2