
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Rita Silva e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Relatório sobre a densidade de um sólido e de um líquido, realizado no âmbito da disciplina de Química (10º ano).
A medida de uma grandeza é o resultado da operação chamada medição e exprime-se através de um número, geralmente acompanhado de uma unidade apropriada. Uma medição pode ser direta ou indireta. Na medição direta compara-se a grandeza a medir com uma unidade da mesma espécie. Na medição indireta, aplica-se uma fórmula que relaciona a grandeza a medir com outras grandezas medidas diretamente.
Cada substância é caracterizada por um conjunto de propriedades físicas e químicas sendo uma delas a densidade. Essas propriedades são também chamadas constantes físicas e permitem, no seu conjunto, identificar e reconhecer cada substância por entre outras, funcionando como o seu “bilhete de identidade”. (1)
A densidade absoluta ou massa volúmica de uma substância é a massa existente em cada unidade de volume dessa substância. Representa-se pela letra grega p (lê-se “ró”), e o seu valor obtém-se pelo quociente entre a massa de uma amostra da substância em estudo e o seu respetivo volume. (1,2)
Medir a massa de uma amostra é uma operação que se denomina, vulgarmente, “pesagem”. O instrumento necessário para essa operação é a balança que geralmente está graduada em gramas. Existem vários tipos de balanças, com alcance e sensibilidade diversas, que exigem uma técnica de pesagem. Essa técnica de pesagem será descrita no Anexo A. (1)
Posto isto, a densidade de um mesmo material é influenciada pela temperatura assim como pelas mudanças de estado. A unidade do Sistema Internacional (SI) de densidade é o kg/m3. Usualmente, as densidades de sólidos e de líquidos exprimem-se em unidades diferentes da unidade do SI, que são: g/cm3 e kg/dm3. (1)
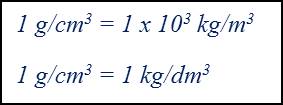
Por vezes, usa-se uma outra grandeza física adimensional, a densidade relativa (d), que é dada pelo quociente entre a massa de um dado volume da substância em estudo e a massa de igual volume de uma substância tomada como referência. (1)

Se considerarmos uma unidade de volume, a densidade relativa passa a ser expressa através das razões entre as densidades da substância em estudo e da substância de referência. (1)

Geralmente, a substância usada como termo de comparação para sólidos e líquidos é a água pura, a 4 ºC, cuja densidade é 1 g/cm3. (1) A água no seu estado natural mais habitual (pura), é um líquido transparente, sem sabor, sem cheiro e sem a presença de outras substâncias para além dos seus componentes originais (um átomo de oxigénio e dois de hidrogénio). (3) Exemplos de densidades relativas de algumas substâncias em relação à água a 4 ºC são:
|
Substância |
Alumínio |
Zinco |
Ferro | Cobre | Chumbo | Silicato Magnésio | Etanol | Água a 4 ºC | Peróxido Hidrogénio |
| Densidade relativa (d) | 2,70 | 7,14 | 7,86 | 8,96 | 11,3 | 3,2 | 0,79 | 1,00 | 1,5 |
Tabela 1 Densidades de algumas substâncias (1,4)
Há processos distintos para a determinação da massa volúmica e da densidade relativa de uma substância.
1.1.3.1 Técnica do Densímetro
Os densímetros são aparelhos flutuantes graduados que dão, por leitura direta, a densidade do líquido em que flutuam. Existem densímetros para ler a densidade de líquidos mais densos do que a água, outros que lêem a densidade de líquidos menos densos que a água e, ainda, outros que se utilizam indiferentemente, quer com os líquidos mais densos, quer com os líquidos menos densos que a água. A determinação da densidade de um líquido através do método do densímetro consiste na leitura direta do valor apresentado no densímetro.
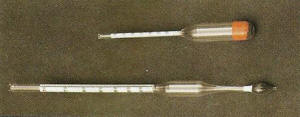
Fig. 1 Dois tipos de densímetros
1.1.3.2 Método do deslocamento de água
Este método tem como objetivo a determinação da densidade de um sólido irregular, utilizando uma proveta cheia de água até um determinado volume. Inicialmente, regista-se esse valor (Vi). De seguida, introduz-se o sólido na proveta anotando-se o seu valor (Vf). Aquando de todo este processo, usamos a fórmula , de modo a calcular o volume do sólido irregular. Com este valor, usamos a fórmula p, de maneira a calcularmos o valor (v) da densidade do sólido irregular.

Fig. 2 Método do Deslocamento de água
1.1.3.3 Técnica do Picnómetro
Esta técnica é utilizada para determinar a densidade de líquidos ou sólidos. Os picnómetros são frascos de vidro de pequena capacidade com forma ligeiramente diferente, consoante se pretenda determinar a densidade de um sólido ou de um líquido. (1) No caso dos líquidos, recorremos à medição da massa do picnómetro vazio (m), do picnómetro cheio do líquido (M’) e cheio de água (M). Após este processo, calculamos a densidade usando a fórmula . Por outro lado, quando queremos determinar a densidade de um sólido recorrendo ao método do picnómetro, medimos a massa do sólido (m). Seguidamente, medimos a massa do picnómetro cheio de água com o sólido ao lado (M) e por fim, a massa do picnómetro cheio de água com o sólido no seu interior (M’). Finalmente, para determinar a sua densidade, usamos a fórmula.
 Fig. 3 Picnómetro de sólidos
Fig. 3 Picnómetro de sólidos |
 Fig. 4 Picnómetro de líquidos
Fig. 4 Picnómetro de líquidos |
1.1.4.1 Silicato de Magnésio (4,8)
O silicato de magnésio, representado pela fórmula Mg2O4Si, é um líquido viscoso, insolúvel cuja densidade apresenta um valor de 3,192.
1.1.4.2 Chumbo (4,6)
O chumbo é um elemento químico de símbolo Pb cujo número atómico é 82 e massa atómica 207,2. Pertence ao grupo 14 da tabela periódica e encontra-se maioritariamente no estado sólido, sendo um metal tóxico, pesado, macio, maleável e mau condutor de eletricidade. O chumbo apresenta uma densidade de 11,3.
1.1.4.3 Peróxido de Hidrogénio (4,7)
O peróxido de hidrogénio, conhecido como água oxigenada, é um líquido claro de fórmula química H2O2 cuja densidade é 1,5.
1.1.4.4 Ferro (4,5)
O ferro é um elemento químico cujo símbolo é Fe, de número atómico 26 e massa atómica 56. Sendo um metal de transição, encontra-se no grupo 8 da Tabela Periódica. À temperatura ambiente, o ferro apresenta-se maioritariamente no estado sólido, tendo uma densidade de 7,86.
A hipótese de estudo que pretendemos ver confirmada ou refutada é se a densidade será uma propriedade física característica de uma substância.
O objetivo geral da atividade experimental a que nos propomos realizar é a determinação da densidade absoluta e da densidade relativa de um sólido e de um líquido de modo a identificarmos materiais no laboratório, respeitando sempre as normas de segurança do mesmo (Anexo B). Pretendemos também analisar os valores obtidos para as densidades e compará-los com os respetivos valores tabelados.

Fig. 5 Caso se exceda o volume, retira-se o excesso de líquido com papel absorvente.
Nesta primeira técnica não foram necessários cálculos porém, interpretando os resultados obtidos, a densidade da substância é 1350.
m = 22,99g
Massa do picnómetro (m) = 24,48g
Massa do picnómetro cheio de água (M) = 48,01g
Massa do picnómetro com a solução (M’) = 48,21g
Massa do sólido em estudo (m) = 0,54g
Massa do picnómetro cheio de água com o sólido ao lado (M) = 78,88g
Massa do picnómetro cheio de água com o sólido dentro (M’) = 78,82g
d = 1350
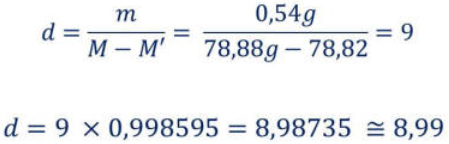
Encontrámos alguns obstáculos durante os cálculos efetuados, como o fator de correção. O fator de correção é usado quando a temperatura da água na experiência é diferente da temperatura padrão (4. No nosso caso, nas experiências com a técnica do picnómetro (tanto para os sólidos como para os líquidos), a água encontrava-se a 18, cuja densidade é 0,998595. A este valor multiplicámos o valor da densidade obtida nas experiências com o picnómetro, de modo a obtermos um resultado de acordo com as condições em que trabalhámos. Outra dificuldade encontrada nesta atividade experimental prende-se com o facto de os densímetros só se adequarem à densidade da substância após três tentativas e de, mesmo assim, o valor obtido não corresponder ao valor tabelado para a substância.
Tendo como objetivo a determinação dos constituintes de cada substância e após termos calculado cada uma das densidades e consultado o Índice de Merck, concluímos que a primeira amostra, calculada a partir do densímetro, tratava-se de Silicato de Magnésio, cuja densidade tem um valor de 3,2. Com a observação direta do densímetro, obtivemos 1350 como densidade para aquela substância, o que nos leva a concluir que a discrepância entre os valores se deve a um erro laboratorial de observação ou ao facto de a substância não ser pura e possuir vários constituintes. A segunda experiência, com um sólido irregular insolúvel, cuja densidade fora calculada a partir do método do deslocamento de água demonstrou ser, provavelmente, uma amostra de chumbo, uma vez que possui uma densidade de 11,5, quando o chumbo possui 11,3. Quanto ao prego, cuja densidade foi calculada através do picnómetro para sólidos, podemos concluir que era uma liga metálica constituída maioritariamente por ferro (cuja densidade é 7,86), apresentando uma densidade de 8,99, pelo facto de ser constituído por vários metais. Por último, ao calcular a densidade de um líquido desconhecido pelo método do picnómetro, o resultado não foi o esperado. A densidade tabelada para a substância que mais se aproxima ao valor pelo grupo calculado (aproximadamente 1,01), é 1,476cm3, que corresponde a água oxigenada. Pensamos que a diferença entre as densidades calculadas e as tabeladas, possa dever-se à falta de pureza das substâncias em causa ou a erros laboratoriais.
Concluímos que a densidade é uma constante física que pode identificar toda e qualquer substância, desde que conhecidas a sua massa e volume.
(1) Dantas MC, Ramalho MD. Caderno de Atividades Laboratoriais Jogo de Partículas A Física e Química A Química – Bloco 1, 10.º/11.º ano. Lisboa: Texto Editores; 2007.
(2) Simões TS, Queirós MA, Simões MO. Química em Contexto Física e Química A Química 10.º ou 11.º (ano 1). Porto: Porto Editora; 2007.
(3) Carneiro R, editor. Tecnologia e Ciências Experimentais. Lisboa: Lexicultural; 1996. (activa multimédia enciclopédia de consulta; vol. 3).
(4) Budavari Susan, editor; J. O’neil, Maryadele, senior associate editor; Smith Ann, associate editor; E. Heckelman Patricia, Assistant Editor; F. Kinneary Joanne, Assistant Editor. The Merck Index – 12ª edição, Whitehouse Station NJ, Merck Research Laboratories; 1996.
(5) http://pt.wikipedia.org/wiki/Ferro
(6) http://pt.wikipedia.org/wiki/Chumbo
(7) http://pt.wikipedia.org/wiki/Per%C3%B3xido_de_hidrog%C3%AAnio
(8) http://www.chemicalbook.com/ProductMSDSDetailCB9674697_EN.htm
(9) http://www2.volstate.edu/CHEM/Density_of_Water.htm