O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Alexandra Faria e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Relatório de actividade experimental cujo objectivo foi conhecer processos para neutralizar resíduos de ácidos/bases, realizado no âmbito da disciplina de Química (11º ano).
No laboratório realizamos a actividade laboratorial AL3 – Neutralização: uma reacção ácido-base. Na sua realização tivemos como objectivos base: o reconhecimento do laboratório como um local de trabalho onde a segurança é fundamental na manipulação de todo o material, equipamento, ácidos e bases, pelo que ao longo desta actividade tivemos cuidados no manuseamentos dos reagentes, evitando o seu contacto directo com a pele e a inalação de gases provenientes destes; não devemos esquecer ainda o uso de óculos de protecção, bata e luvas.
Conhecer processos para neutralizar resíduos de ácidos/bases, o que nos permite pois responder à questão problema desta actividade: “Como minimizar os efeitos de uma queimadura com ácido sulfúrico?”. Deve ser-lhe adicionada uma base, pois esta neutraliza o efeito do ácido.
Previamente, tivemos a necessidade de saber o que é e como se realiza uma titulação; pelo que, uma titulação consiste num método de análise volumétrica para determinação da concentração de uma solução mediante a utilização de uma solução padrão de concentração rigorosamente conhecida (neste caso NaOH), contida numa bureta (o titulante), que se adiciona lentamente á solução em análise (o titulado: solução cuja concentração se pretende determinar.).
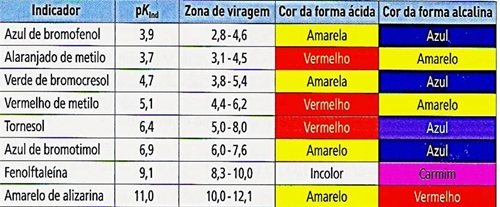
Numa titulação o pretendido é conhecer o ponto de equilíbrio, ou seja o ponto exacto em que termina a titulação - ponto de equivalência - mas na verdade o que se conhece é o ponto final, momento em que há variação de uma propriedade física ou química no titulado. A diferença entre o ponto de equivalência e o final chama-se erro de titulação. Neste caso, a alteração física observada na experiência feita, foi a da coloração (por mais de 30 segundos) da substância, devido á adição prévia de um indicador colorimétrico (fenolftaleína). Um indicador colorimétrico ácido-base é um par conjugado ácido-base, em que as formas ácidas e básicas são responsáveis por cores diferentes de soluções. Por isso, há que ter em conta, a correcta selecção dos indicadores em cada titulação, pois este deve mudar de cor bruscamente, e a sua zona de viragem tem de estar contida na zona de variação brusca de pH, embora seja preferível que a zona de viragem contenha o pH no ponto de equivalência (ver anexos).
Aprofundando agora as titulações ácido-base, a que se refere o trabalho realizado, tal como o próprio nome indica, nesta volumetria a reacção que ocorre é uma reacção ácido-base e a propriedade que varia ao longo da titulação, à medida que se adiciona titulante, é o pH do titulado. É, portanto, muito importante conhecer o tipo de variação do pH no decurso de uma titulação de ácido-base. Ao efectuar-se um gráfico de variação do pH em função do volume adicionado de titulante obtêm-se uma curva a que se chama curva de titulação.
Podemos considerar três tipos diferentes de titulações:
1 - Titulações envolvendo um ácido forte e uma base forte;
2 - Titulações envolvendo um ácido fraco e uma base forte;
3 - Titulações envolvendo um ácido forte e uma base fraca.
A titulação realizada envolveu um ácido forte e uma base forte. Quando temos uma reacção entre um ácido e uma base fortes, a ionização do ácido e a dissociação da base são ambas completas. A 25ºC e no ponto de equivalência a solução é neutra, pelo que o pH da solução é 7.
Outra das fases importantes nas titulações é a fase dos cálculos. O cálculo da concentração da solução a analisar faz-se partindo de um cálculo estequiométrico simples. Para tal, conhece-se a equação química que traduz a reacção ocorrida na titulação, e também o volume do titulante e o volume ou massa de titulado gasto na titulação. Aplica-se, então, a seguinte fórmula: CA x VA = CB x VB .
Respondendo à questão problema desta actividade: “Como minimizar os efeitos de uma queimadura com ácido sulfúrico?”, deve ser-lhe adicionada uma base, pois esta neutraliza o efeito do ácido.
4 Balões Erlenmeyer;
1 Bureta de 50,00 mL;
1 Esguicho;
1 Funil para buretas;
1 Pipeta volumétrica de 20 mL;
1 Placa com agitador magnético;
1 Pompete ou pipetador automático;
1 Suporto Universal com garras;
1 Sensor de pH ou medidor de pH.
Solução de ácido forte (HCl), 0,050 mol.dm-3;
Solução de base forte (NaOH), 0,10 mol.dm-3;
Solução alcoólica de fenolftaleína e/ou indicador de metilo.
1ª Parte – Para a titulação




2ª Parte – Para o traçado da curva de titulação




A concentração do titulante tem de ser rigorosamente conhecida, estando pois previamente preparada, não podendo assim ser preparada na escola, pois o material lá existente não permite a obtenção de uma solução precisa.
À medida que se ia adicionando, gota a gota, o titulante (NaOH), a cor inicial do titulado (HCl), ao qual foram previamente adicionadas 3 gotas de Fenolftaleína, ia alterando a sua cor, ganhando uma tonalidade carmim. Nas primeiras gotas, essa cor, no entanto, desaparecia, sendo que apenas se mantinha após algumas gotas de titulante.
O quadro seguinte refere-se aos valores do volume de titulante utilizado, para se atingir o ponto de equivalência da reacção.
| Ensaio | Medição do volume de titulante | ||
| Vi (mL) | Vf (mL) | Volume efectivamente utilizado (ΔV – mL) | |
| 1 | 0 | 20,40 | 20,40 |
| 2 | 0 | 20,30 | 20,30 |
| 3 | - | - | - |
| pH | Vad. NaOH/mL | pH | Vad. NaOH/mL |
| 1,62 | 0,00 | 3,50 | 19,90 |
| 1,79 | 5,60 | 3,67 | 20,00 |
| 1,98 | 10,00 | 3,97 | 20,10 |
| 2,09 | 12,00 | 4,30 | 20,20 |
| 2,22 | 14,00 | 5,09 | 20,25 |
| 2,39 | 16,00 | 6,25 | 20,30 |
| 2,52 | 17,00 | 9,37 | 20,35 |
| 2,60 | 1750 | 9,95 | 20,45 |
| 2,69 | 18,00 | 10,61 | 20,60 |
| 2,78 | 18,50 | 11,13 | 21,00 |
| 2,95 | 19,00 | 11,58 | 22,00 |
| 3,16 | 19,50 | 11,79 | 23,00 |
| 3,29 | 19,70 | 12,00 | 25,00 |

[NaOH] = 0,1 M
V= 25 mL
[HCl] = 0,05 M
V = 20 mL
Calcular o volume de NaOH
No ponto de equivalência:
nB = nA
como: C=n/v temos que: [NaOH] x Vef.gasto = [HCl] x VHCl
0,1 X Vef.gasto = 0,05 X 20 Û Vef.gasto = 10 mL
Calcular a concentração inicial de HCl
Durante a titulação:
HCl(aq) 1 mol + NaOH(aq) 1 mol → H2O(l) + NaCl(aq)nHCl = nNaOH
CHCl X VHCl = CNaOH X VNaOH → Vef.gasto = 10 mL
CHCl X 20 = 0,1 X 10 Û CHCl = 0,05 M
Após a realização da experiência, e depois de feitos os cálculos, verificou-se que os volumes utilizados nos diferentes ensaios foram diferentes, embora se encontrassem dentro dos valores correctamente admissíveis. Estes valores representam aproximadamente o ponto de equivalência da reacção, que observamos a partir da mudança de cor do indicador adicionado ao titulado (Fenolftaleína) à medida que se foi adicionando o titulante (NaOH). Assim, a cor inicial da solução de HCl (titulado), foi substituída por uma cor carmim, cuja permanência nos acusa o ponto de equivalência.
O pH inicial da solução de HCl é baixo. À medida que adicionamos NaOH, o OH- reage com o ácido, e o pH começa a subir gradualmente. Perto do ponto de equivalência, a variação de pH com a adição de base é muito brusca e a curva de titulação torna-se praticamente vertical. Depois de todo o ácido ser consumido, a adição de mais base sobe o pH cada vez mais lentamente, até que o pH da solução seja semelhante ao da base.
Neste tipo de titulação (cuja reacção é completa), o ponto de equivalência é superior a 7, porque neste ponto a solução resultante da reacção entre titulante e titulado tem pH maior que 7, devido ao facto do sal formado (que está em solução aquosa) derivar do ácido fraco e da base forte. Foi também devido a isto que utilizamos a Fenoftaleína como indicador.
A reacção ocorrida pode ser representada pela seguinte equação química: HCl(aq)+NaOH(aq) à H2O(l)+NaCl(aq).