
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Daniela Alexandre e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Trabalho escolar (relatório de experiência) sobre o tema preparação de soluções, realizado no âmbito da disciplina de Química (10º ano).
Numa aula da disciplina de físico e química, foi-nos solicitado pelo professor a execução de uma experiência prático-laboratorial, em que se pretendia dar a conhecer aos alunos como se preparava soluções.
A atividade proposta dividiu-se então em duas partes iguais, em que na primeira usaríamos tiossulfato de sódio e para a segunda fase, repetiríamos a experiência mas com um componente químico diferente, sulfato de cobre II.
Nota: Há que recordar que para se trabalhar com produtos reagentes é preciso respeitar as normas de segurança, algumas delas são: não cheirar a substância em utilização; ler sempre os rótulos e tomar conhecimento das regras estabelecidas pelos mesmos; e usar bata e muitas vezes luvas.
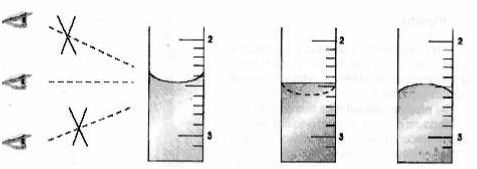
Esquema 1- representação da leitura correta de medições a olho.
As substâncias que foram utilizadas na atividade pratico-experimental são os compostos designados por:
Nota: não retirar o excesso de sólido, a não ser para um novo recipiente, nunca para a embalagem onde contém a solução.
Esta experiência prático-laboratorial tem como objetivos:
A segunda experiência:
Pesagem do sal:
1º. Nivelou-se a balança de precisão;
2º. Colocou-se o gobelé na balança, e com a ajuda da espátula, colocou-se pouca a pouco o sal em questão;
3º. Tentou-se obter um valor próximo do pretendido (0,37g);
4º. Registou-se o valor exato da massa desejado;
Dissolução do sal:
1º. Adicionou-se 25ml de água na proveta;
2º. Esvaziou-se a água da proveta para o gobelé que contém o sal pesado;
3º. Agitou-se o gobelé até estar completa a dissolução do sal;
4º. Transferiu-se a solução para o balão volumétrico;
5º. Encheu-se o balão volumétrico com água até ao traço de referência através de um esguicho;
Preparação de uma solução diluída, a partir da solução diluída anterior:
1º. Colocou-se um pipetador na parte de cima da pipeta volumétrica
2º. Começou-se por transferir a solução, que se encontrava no balão volumétrico, para a pipeta até chegar ao traço de referência da mesma;
3º. Transferiu-se, já com a solução dentro da pipeta volumétrica, a solução para um outro balão volumétrico.
4º. Retirou-se os dados e conclusões pretendidas;
5º. Depositou-se todas as soluções no lavatório;
6º. Procedeu-se à lavagem de todos os materiais utilizados;
Nota: não foram necessários cálculos para o tiossulfato de sódio, pois o manual dispunha o valor que era imprescindível pesar para proceder à experiência.


Legenda das imagens:
1º. Determinar a massa molar correspondente ao soluto em utilização:
M (CuSO4) = 249,69 g/mol-1 (este valor estava apresentado no frasco que continha a solução)
1º. Determinar a quantidade de soluto (n) na solução a preparar a partir da fórmula:
2º. Calcular a massa de soluto a partir da fórmula:
Encontrou-se assim o valor pretendido de sulfato de sódio a pesar: 0,37g.

Figura - À esquerda o balão volumétrico que contém a solução diluída, e à direita um outro que contém a solução anterior.
Na atividade prático-laboratorial, testámos dois tipos de soluções, e conseguimos concluir que quanto maior for a quantidade de soluto presente num dado volume de solução, maior é a sua concentração. Por isso, nas soluções mais concentradas existe maior quantidade de soluto do que nas soluções diluídas, para um mesmo volume de solução.
Nas experiências laboratoriais que foram realizadas, o soluto utilizado que mais conseguimos tirar conclusões foi o sulfato de cobre II, pelo motivo que a cor deste mesmo na solução inicial, era mais forte, visto ser a mais concentrada e, mais clara, na solução final, visto que sofreu um processo de diluição.
Por fim, avaliamos positivamente o trabalho em grupo, ao longo dos procedimentos, não cometemos qualquer erros matemático que prejudicasse o resultado final ou diferente dos resultados dos outros grupos, conseguimos atingir os objetivos propostos e adquirir, experiência laboratorial nomeadamente ao nível de manejo de materiais e ao aprofundamento dos conhecimentos dos diferenciados métodos de preparação de soluções.