
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Tatiana Rodrigues e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Esta atividade experimental tem como objetivo preparar uma solução aquosa de sulfato de cobre (II) penta-hidratado com um volume de 100 ?? e com uma concentração de 0,100 ???/??! (preparar uma solução aquosa a partir de um soluto sólido) e, em seguida, realizar a sua diluição e determinar a concentração da solução diluída com fatores de diluição iguais a 5 e 10 (diluição de soluções).
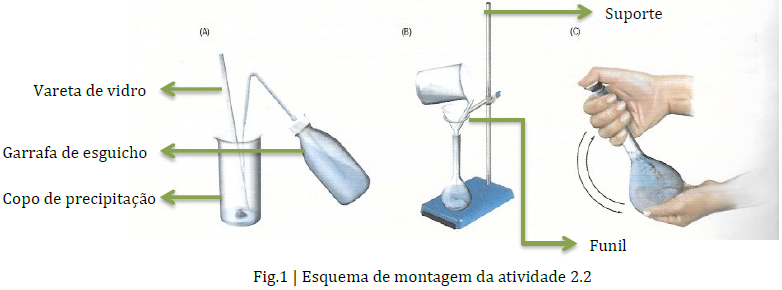
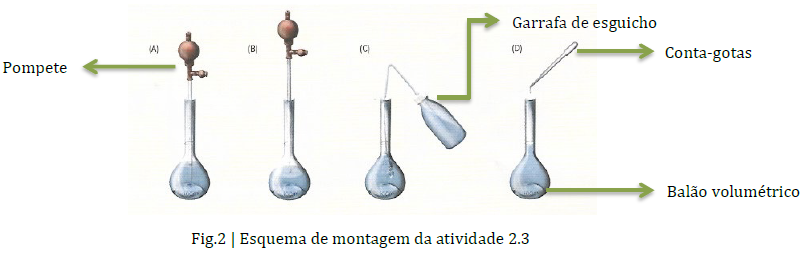
O sulfato de cobre(II) penta-hidratado não é uma substância que exija cuidados especiais para além dos usuais no laboratório de Química: luvas, bata e óculos de segurança. Contudo, em caso de inalação deve retirar-se para um local ventilado; em caso de contacto com a pele, deve lavar com água; em caso de contacto com os olhos deve lavar com água e em caso de ingestão e mal-estar deve consultar um médico.
Durante a medição da massa do soluto, não se deve colocar a amostra diretamente sobre o prato da balança, mas dentro de um recipiente limpo e seco (o recipiente deve estar à temperatura ambiente, porque o corpo ou material aquecido provoca correntes de ar que introduzem erros na pesagem). Deve-se evitar vibrações na mesa ou na bancada onde se encontra a balança.
É importante lavar o copo de precipitação (ponto 6 do procedimento de soluções a partir de solutos sólidos) com água desionizada para que não reste soluto no mesmo, de modo a não afetar a quantidade de soluto existente na solução.
Depois de proceder à homogeneização da solução (ponto 7 e 8 do procedimento de soluções a partir de solutos sólidos;ponto 4 do procedimento de diluição de soluções) deve-se verificar se existem bolhas de ar. Caso estas existam deve-se dar umas batidas no corpo do balão volumétrico até que as bolhas desapareçam (a presença de bolhas poderá afetar a medição do volume da solução). Quando se enche o balão volumétrico com água desionizada a partir do esguicho, este deve ter a ponta por onde sai a água encostada à parede do balão, evitando assim o aparecimento de bolhas.
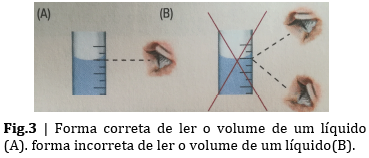
Deve-se ter cuidado ao efetuar a leitura do nível de líquido no colo do balão de modo a medir corretamente o volume de solução aquosa, tanto no balão volumétrico como na pipeta graduada para não se cometer erros de paralaxe (erros associados à incorreta posição do observador).
Quando se adicionou água desionizada ao soluto sólido, preparou-se uma solução aquosa. Durante essa preparação verificou-se uma mudança de cor para azul marinho (cor do sulfato de cobre).
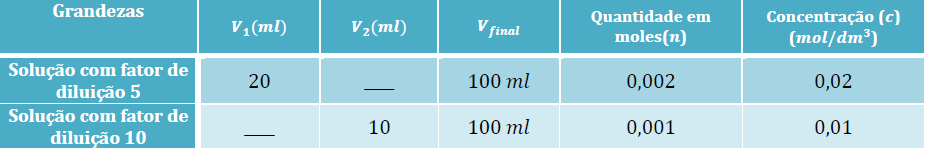
1º Registar os dados que já nos são fornecidos:
2º Calcular a quantidade de soluto que deve existir na solução, atendendo ao volume e à concentração pretendidas:
? = ? / ? ⇔ ? = ?×? ⇔ ? = 0,100×0,100 ⇔ ? = 0,0100 ???
3º Calcular a massa de soluto (????4. 5?2?) a medir, atendendo à quantidade de soluto já calculada e à massa molar (M) do soluto:
? = ?/? ⇔ ? = ?×? ⇔ ? = 0,0100×249,69 ⇔ ? = 2,50?
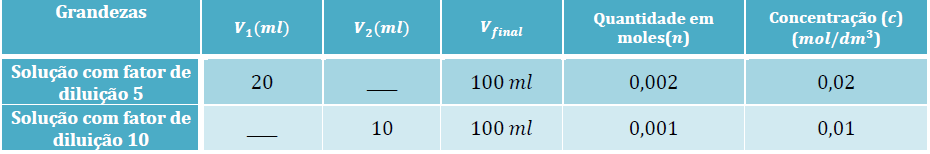
1º Registar os dados que já nos são fornecidos (atividade 2.2):
2º Calcular o volume (?1) a retirar da solução-mãe, considerando o fator de diluição, f, igual a 5:
3º Calcular o volume (?2) a retirar da solução-mãe, considerando o fator de diluição, f, igual a 10:
Soluções a partir de solutos sólidos (atividade laboratorial 2.2)

Diluição de soluções (atividade laboratorial 2.3)
Durante a realização da atividade poderão ter ocorrido algumas discrepâncias durante a medição das grandezas, uma vez que os equipamentos usados tem uma certa sensibilidade: balança analítica com uma incerteza de ±0,01 ?; balões volumétricos de 100 ?? com uma incerteza de ±0,08 ??.
• Erros associados à medição da massa do soluto na balança:
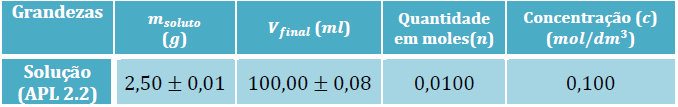
Nesta parte da atividade foi necessário calcular a massa de soluto necessária para se poder obter uma solução aquosa de sulfato de cobre (II) penta-hidratado (????!. 5?!?) com um volume de 100 ?? e com uma concentração de 0,100 ???/??!. Primeiro procedeu-se à medição indireta (medir através de cálculos) do soluto:
?(????4. 5?2?) = 249,69 ?/???
? =?/? ⇔ ? = ?×? ⇔ ? = 0,100×0,100 ⇔ ? = 0,0100 ???
? = ?/? ⇔ ? = ?×? ⇔ ? = 0,0100×249,69 ⇔ ? = ?, ?? ?
De seguida, procedeu-se à medição direta (ato de medir) do soluto. É nesta altura que a medição pode ser afetada, ou por movimento brusco do operador sobre a mesa onde se encontra a balança, ou por movimentos bruscos de vento que poderão afetar a pesagem do soluto.
• Erros associados à lavagem do copo de precipitação:
Quando se lava o copo de precipitação com água desionizada para que não reste soluto no mesmo, (para não afetar a quantidade de soluto existente na solução) poderá ter restado um pouco de soluto no copo de precipitação, o que irá diminuir a quantidade de soluto na solução e aumentar a sua concentração.
• Erros associados á medição de volume no balão volumétrico:
Na realização desta atividade usou-se um balão volumétrico para medir o volume da solução, uma vez que é um dos aparelhos usados para medidas rigorosas (tem menor incerteza). Os balões volumétricos têm um traço de referência na zona tubular, indicativo do nível a que deve ficar o líquido a medir para que se tenha o volume correspondente à capacidade do balão.
A superfície livre de um líquido contido num instrumento de medida apresenta-se sempre ligeiramente encurvada na periferia devido à tensão superficial. A leitura deverá ser feita de modo que a direção do olhar coincida com a linha tangente à parte interna do menisco (A). Sempre que a direção do olhar não coincide com a linha tangente ao menisco cometem-se erros de paralaxe (B). Uma leitura incorreta do volume levará a resultados diferentes de volume e concentração, afetando a atividade.
Durante a homogeneização da solução, poderão formar-se bolhas de ar. Apesar das tentativas para fazer desaparecer as bolhas de ar (dando batidas no corpo do balão volumétrico e na pipeta graduada) poderão ter ficado alguma(s) bolha(s) de ar.
Na realização da atividade 2.3 não se respeitou o protocolo, isto porque, se usou uma pipeta graduada em detrimento da pipeta volumétrica por falta desta. É muito importante mencionar este facto, uma vez que, o uso da pipeta graduada torna o resultado menos rigoroso. Isto deve-se ao facto de a pipeta graduada ter uma menor incerteza em relação à pipeta volumétrica; e quanto menor a incerteza “pior” é o resultado da atividade. Apesar do sucedido os resultados foram os esperados.
Diluir uma solução aquosa consiste em diminuir a sua concentração, por adição de mais água desionizada. Sendo assim, para duas soluções com o mesmo volume, mas com quantidades diferentes de soluto, a que tem uma maior quantidade de soluto é a solução mais concentrada. Notou-se uma diferença bastante notória da solução mãe (solução preparada na atividade 2.2) para as soluções diluídas. Essa diferença está na intensidade da cor da solução: a solução-mãe, que estava mais concentrada, tinha como cor um azul-marinho muito intenso; a solução diluída com fator de diluição igual a 5 tinha uma cor menos intensa que a solução mãe, uma vez que se diminui a concentração; a solução diluída com fator de diluição igual a 10 tinha uma cor menos intensa que a solução-mãe e do que a solução diluída com fator de diluição igual a 5, devido à diminuição do fator de diluição. Verifica-se assim que quanto maior o fator de diluição de uma solução menor é a sua concentração e a intensidade da cor.
No final desta atividade conseguimos cumprir o objetivo: preparou-se uma solução aquosa de sulfato de cobre (II) penta-hidratado (????!. 5?!?) com um volume de 100 ?? e com uma concentração de 0,100 ???/??!; preparou-se duas soluções diluídas (ambas com 100 ??) tendo como fatores de diluição o 5 e o 10.
Esta atividade permitiu-nos: concluir que quanto mais concentrada é uma solução mais intensa é a sua cor; aprendemos a manusear corretamente os instrumentos de laboratório; aprendemos como se prepara uma solução a partir de um soluto sólido e como preparar a diluição de uma solução.