
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Ana Anastácio e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Trabalho sobre a tabela periódica (organização dos seus elementos químicos), realizado no âmbito da disciplina de Física (10º ano).
Os elementos químicos actualmente conhecidos estão organizados numa tabela – a Tabela Periódica.
Para a construção desta tabela, até à organização actual, contribuíram vários cientistas destacando-se os trabalhos de Dobereiner em 1817, e, mais tarde, de Newlands, Mendeleev, Moseley , entre outros.
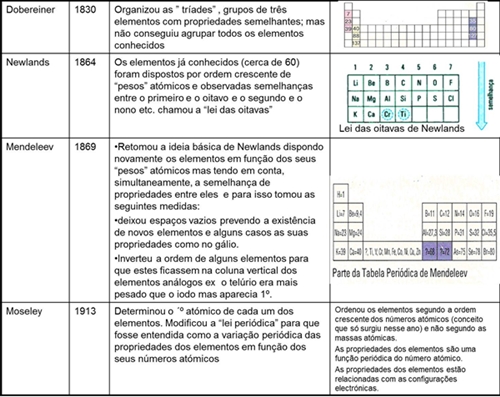
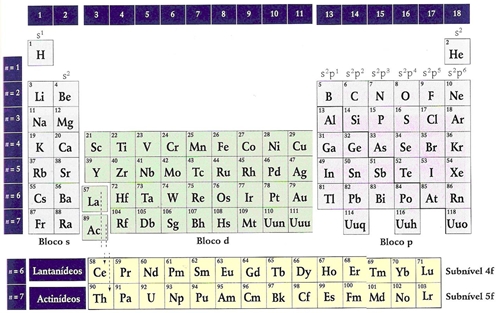
A organização da T.P está relacionada com a distribuição electrónica dos átomos dos elementos. Os elementos estão distribuídos por ordem crescente do nº atómico. A T.P. está organizada em 18 grupos que são as colunas verticais e sete períodos que são as filas horizontais. Os elementos do mesmo grupo têm propriedades químicas semelhantes. Quando a semelhança entre elementos do mesmo grupo é muito acentuada os grupos constituem famílias:
Os elementos dos grupos 1, 2, 13 a 18 chamam-se elementos representativos sendo os restantes designados por elementos de transição. Os elementos representativos são os elementos que têm em preenchimento as subcamadas s ou p de maior número quântico principal
Os grupos estão agrupados em blocos de acordo com o tipo de orbital de valência em preenchimento.
Os grupos 1 e 2 formam o bloco s estando em preenchimento orbitais de valência tipo s
Os grupos 13 a 18 formam o bloco p estando em preenchimento orbitais de valência tipo p
Os grupos de 3 a 12 formam o bloco d estando em preenchimento orbitais de valência tipo d
As séries dos lantanídeos e actinídeos formam o bloco f porque estão em preenchimento orbitais de valência tipo f
Grupo: o nº de electrões de valência destes elementos coincide com o algarismo das unidades do grupo com excepção do hélio que tem 2 electrões mas pertence ao grupo 18.
Período: o período a que pertence estes elementos coincide com o nº de níveis ou seja com o valor mais elevado do nº quântico principal
Exemplo: 16S – 1s2 2s2 2p6 3s2 3p4
Grupo - 16 porque tem 6 electrões de valência
Período – 3 porque tem 3 níveis de energia
A T.P. apresenta valores para diversas propriedades, umas que são propriedades dos elementos e outras que são propriedades das substâncias elementares da qual o elemento faz parte


Propriedades que dizem respeito ao elemento:
Propriedades das substâncias elementares:
As propriedades que dizem respeito ás substâncias elementares dependem do modo como os átomos estão ligados nas substâncias.
Exemplo - o mesmo elemento forma duas substâncias elementares com propriedades completamente distintas: O diamante substância de elevada dureza;
Grafite substância macia utilizada nos lápis de escrever.
A razão desta diferença está na maneira como os átomos estão ligados numa e noutra substância
Raio atómico e raio iónico
O áto mo , como se sabe, é constituído por um núcleo e uma nuvem electrónica que não tem limites definidos: os electrões podem encontrar-se a qualquer distância do núcleo, havendo zonas de maior probabilidade da sua presença. Na prática, considera-se o átomo como uma esfera onde há 95% de probabilidade de encontrar o electrão. No entanto, os átomos não se encontram isolados (excepto os gases nobres), mas sim empacotados em sólidos cristalinos ou formando moléculas. Nestas situações os seus centros encontram-se a distâncias mensuráveis e bem definidas.

Representação da orbital pela nuvem electrónica

Representação da orbital pelo espaço limitado por uma superfície esférica que contém 95% da nuvem electrónica

Ao longo do grupo - cada novo elemento apresenta mais uma camada na nuvem electrónica, estando os electrões periféricos, em média, mais afastados do núcleo. Por isso o raio atómico aumenta.
Ao longo do período – de elemento para elemento o nº de electrões e a carga nuclear aumenta numa unidade. No entanto, os electrões vão ocupar orbitais da mesma camada mas sujeitos a uma maior atracção nuclear, provocando por isso uma contracção da nuvem e, portanto uma diminuição do raio atómico.

O raio atómico decresce genericamente, da esquerda para a direita e aumenta ao longo do grupo de cima para baixo, para os elementos representativos
Ião positivo ou catião - o raio iónico é menor que o raio atómico devido à perda de um ou mais electrões (que pode corresponder à perda de um nível ou camada), mantendo a mesma carga nuclear.

Ião negativo ou anião – o raio iónico é maior que o raio atómico devido ao ganho de um ou mais electrões mantendo a mesma carga nuclear.


Quanto maior for a carga nuclear para o mesmo nº de electrões maior será a força atractiva, o que provoca a contracção da nuvem electrónica e diminuição do raio da partícula.
Exemplo:
Energia de 1ª ionização é a energia mínima necessária para remover um electrão do átomo, na fase gasosa e no estado fundamental.
Para o cobre, a sua 1ª ionização pode traduzir-se por:
Cu (g) + Ei → Cu+ (g) + e- Ei ou I1 = 785 kJ mol-1
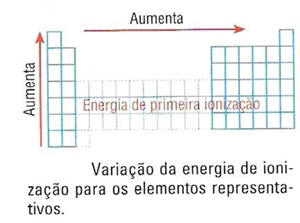
As energias de 1ª ionização para os elementos representativos :

A 1ª energia de ionização (ou simplesmente energia de ionização) diminui ao longo do grupo devido ao aumento do nº de camadas, ou seja, da distância dos electrões de valência ao núcleo, diminuindo assim, a força atractiva do núcleo aos electrões de valência, sendo por isso mais fácil a remoção de um electrão
Ao longo do período, a energia de 1ª ionização, em geral, aumenta devido ao sucessivo aumento da carga nuclear, o que faz aumentar a força atractiva núcleo – electrões, e mais difícil se torna a remoção de um electrão.
Quadro resumo da variação de algumas propriedades dos elementos ao longo da T.P.
