
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Ana Margarida Cerqueira e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Trabalho sobre as técnicas de reprodução medicamente assistida, realizado no âmbito da disciplina de Biologia (12º ano).
A reprodução é a “função (do grupo das funções da vida vegetativa) que permite aos seres vivos produzirem outros semelhantes, mantendo-se a espécie” (Diciopédia 2005, Porto Editora Multimédia). Apesar de ser uma  função comum a todos os seres vivos, a reprodução, por vezes, torna-se um acontecimento biologicamente impossível, nomeadamente no ser humano. Esta realidade impôs desde cedo vários desafios à ciência: a identificação das diversas causas de infertilidade e respectivo tratamento e ainda o desenvolvimento de métodos e técnicas que permitissem aos casais inférteis a produção de descendência.
função comum a todos os seres vivos, a reprodução, por vezes, torna-se um acontecimento biologicamente impossível, nomeadamente no ser humano. Esta realidade impôs desde cedo vários desafios à ciência: a identificação das diversas causas de infertilidade e respectivo tratamento e ainda o desenvolvimento de métodos e técnicas que permitissem aos casais inférteis a produção de descendência.
É exactamente sobre este último desafio colocado à ciência, a reprodução medicamente assistida, que o nosso trabalho vai incidir.
Primeiramente daremos uma pequena introdução sobre a infertilidade e suas causas o que nos remeterá para o próximo ponto do trabalho, as técnicas de reprodução medicamente assistida. Falaremos ainda das técnicas complementares que são essenciais para que a fecundação e normal desenvolvimento do embrião possa acontecer, sendo este o objectivo fundamental de todo o processo.
Seguidamente faremos um breve apontamento acerca dos riscos que a concepção assistida comporta.
Por fim, procederemos a uma pequena reflexão acerca da situação em Portugal no que concerne a este assunto e ainda abordaremos de forma ténue a faceta bioética de todo este tema.
Geralmente a comunidade médica considera que um casal é infértil e passível de ser submetido a exames de diagnóstico quando, após um ano de relações sexuais, pelo menos duas vezes por semana, não consegue procriar, naturalmente sem o uso de nenhum método contraceptivo.
Cerca de 52% dos casos de infertilidade estão associados à mulher. As causas mais comuns são:
As principais doenças causadoras de infertilidade são: doença do ovário poliquístico (PCOD), doença inflamatória pélvica, disfunção da fase luteínica, doença obstrutiva tubárica, doença genéticas (síndrome de Tunner), atresia folicular acelerada entre outras.
No Homem, a infertilidade está relacionada com os seguintes problemas:
Após o casal efectuar os exames solicitados pelos médicos para determinação das causas da infertilidade, e depois da avaliação destes por parte da equipa médica, será escolhido o procedimento que melhor se adequa ao problema detectado.
Desde que em 1978 foi noticiado que o obstetra Patrick Steptoc e o biólogo Robert Edwards trouxeram ao mundo Louise Brown, o primeiro bebé-proveta resultante da técnica de fecundação in vitro, cerca de um milhão e meio de bebés nasceram, em todo o mundo, de casais estéreis. Ao mesmo tempo, as técnicas de reprodução assistida experimentaram um forte desenvolvimento na maioria dos países desenvolvidos, existindo hoje ainda várias técnicas, sejam elas com recurso a medicamentos, técnicas laboratoriais de manipulação e selecção de gâmetas e embriões ou com recurso a cirurgia.
Inseminação Artificial ou IUI (Intra-Uterine Insemination)
Esta técnica é empregada em casos de incapacidade de ejaculação, distúrbios de ovulação, alterações no muco cervical, que impeçam a livre penetração dos espermatozóides no útero, determinadas alterações na qualidade do sémen, alterações nas trompas e endometriose.
A Inseminação Artificial consiste em depositar os espermatozóides, previamente capacitados em laboratório, no interior do útero, usando meios artificiais em vez de cópula natural.
Existe ainda outra modalidade que consiste na introdução dos espermatozóides no cérvix (inseminação intra-cervical).
Geralmente, realiza-se previamente a indução controlada da ovulação. Quando um oócito II é libertado, é realizada a transferência dos espermatozóides do parceiro ou doador para o útero, utilizando um fino cateter sem qualquer anestesia ou internamento. Na inseminação, os espermatozóides são separados do líquido seminal, através de centrifugação, já que como são colocados acima do orifício interno do colo do útero, o líquido seminal, que funciona como meio de transporte para os espermatozóides, não é necessário. O líquido seminal é substituído por um meio de cultura adequado.
A fertilização, neste caso, é in vivo, dentro das trompas de Falópio.
Neste processo não é necessário repouso para além dos 30 minutos que se seguem à inseminação ou modificação da vida pessoal.
As hipóteses de sucesso desta técnica são de aproximadamente 18 a 20%.
Fertilização in vitro ou IVF (In Vitro Fertilization)
Esta técnica, também denominada “bebé-proveta”, pelo facto de a fecundação ocorrer no exterior do corpo feminino, em laboratório, foi uma das grandes conquistas no tratamento da fertilidade.
 A IVF é indicada em casos de lesão das trompas, gravidez ectópica, laqueação irreversível das trompas de Falópio, endometriose, infertilidade masculina e em casos de infertilidade sem causa aparente.
A IVF é indicada em casos de lesão das trompas, gravidez ectópica, laqueação irreversível das trompas de Falópio, endometriose, infertilidade masculina e em casos de infertilidade sem causa aparente.
Esta técnica divide-se em várias fases:
Devido à aspiração folicular, o teor de progesterona produzido é insuficiente para que ocorra a posterior implantação do embrião, daí que seja necessário administrar progesterona intramuscular, oral ou vaginal à paciente.
É de referir que a paciente, quando impossibilitada completamente de ovular, pode obter o gâmeta feminino recorrendo a um banco de oócitos.
Relativamente aos espermatozóides, normalmente a colecta é feita por masturbação. No caso de o paciente apresentar azoospermia, são adoptadas técnicas especiais para retirar os espermatozóides dos epidídimos ou dos testículos, sendo seleccionados os que têm maior mobilidade e capacidade para fertilização. Os espermatozóides podem ainda provir de um banco de esperma, caso o paciente não tenha mesmo possibilidade de produzir espermatozóides.
Depois de colhidos os gâmetas, o próximo passo é realizar a fertilização dos oócitos II num meio de cultura que simula o ambiente das trompas. Os espermatozóides são colocados em contacto com os oócitos para que um deles penetre a zona pelúcida. Os óvulos e espermatozóides permanecem juntos durante 12 a 18 horas, período após o qual são examinados ao microscópio. Na observação microscópica procurar-se-á um sinal de fecundação normal, ou seja, a presença de dois pró-núcleos.
Fertilização normal
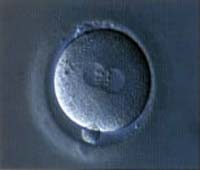 2 pró-núcleos
2 pró-núcleos |
Fertilização Anormal
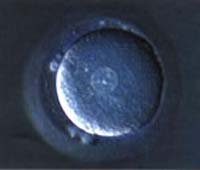 1 pró-núcleo
1 pró-núcleo |
Fertilização Anormal
 3 pró-núcleos
3 pró-núcleos |
Os zigotos com um ou mais de dois pró-núcleos são rejeitados já que resultam em embriões geneticamente alterados.
Os óvulos fertilizados são incubados no mesmo meio de cultura durante 48 horas até que atinjam o estado de embrião com 6-8 células.
De seguida, o melhor embrião é transferido para o útero através de um cateter especial de plástico com monitorização ecográfica (a FIV é também designada FIV-ET (Embryo Transfer)). Por vezes, vários embriões são transferidos para o útero para aumentar as hipóteses de implantação e gravidez.
Cerca de duas semanas após a transferência embrionária, realizam-se testes de gravidez, medindo-se os níveis de hCG (Gonadotrofina Coriónica Humana) no sangue.
A taxa de sucesso varia entre 20 e 35% em mulheres até 35 anos. A partir dos 40 anos, a taxa de gravidez já é de 15%.

Esquema da técnica de fecundação in vitro
Injecção Intracitoplasmática de Espermatozóides, Microinjecção ou ICSI (Intracytoplasmatic Sperm Injection)
Esta técnica hoje em dia é a melhor técnica de tratamento da infertilidade atingindo 50% de êxito em mulheres com menos de 35 anos. Por esse motivo, tem vindo a substituir a fertilização in vitro nas clínicas de reprodução assistida, já que os seus resultados são melhores.
A ICSI é especialmente indicada para o tratamento da infertilidade masculina (poucos ou nenhuns espermatozóides no ejaculado, espermatozóides com baixa mobilidade, percentagem baixa de espermatozóides com morfologia normal).
A recolha dos gâmetas feminino e masculino é efectuada da mesma forma que na técnica de fertilização in vitro.
A técnica de ICSI é realizada com auxílio de micromanipuladores unidos ao microscópio e consiste em injectar um único espermatozóide directamente dentro do oócito, fomentando assim a fecundação. O trabalho é feito numa placa de Petri com duas micropipetas (mais finas que um fio de cabelo): uma delas vai segurar o oócito e a outra vai pegar o espermatozóide, imobilizá-lo e injectá-lo dentro do oócito, ultrapassando a zona pelúcida.

Imobilização do espermatozóide

Colocação do espermatozóide na micropipeta de injecção pela cauda

Início da injecção do espermatozóide (no interior da micropipeta) no óvulo
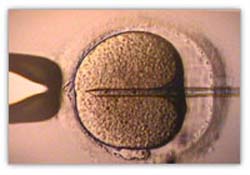
Micropipeta com espermatozóide totalmente dentro do oócito
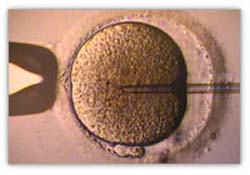
Injecção do espermatozóide e retirada da micropipeta
A verificação da fecundação é feita após cerca de 18 horas, através do microscópio. É verificada a presença de pró-núcleos e corpúsculos polares e a presença de anormalidades. Após este procedimento, as placas de Petri são incubadas durante cerca de 72 horas.
Os embriões resultantes são implantados no útero através das mesmas técnicas da fertilização in vitro atrás descritas.
Transferência intratubárica de gâmetas ou GIFT (Gamete Intrafallopian Transfer)
A GIFT é indicada para casos em que a infertilidade se relaciona com disfunções do esperma, quando a causa de infertilidade é desconhecida ou quando existem anomalias no muco cervical.
 Nesta técnica, os gâmetas são obtidos pelas mesmas técnicas utilizadas na fertilização in vitro e na microinjecção.
Nesta técnica, os gâmetas são obtidos pelas mesmas técnicas utilizadas na fertilização in vitro e na microinjecção.
Após serem tratados e seleccionados em laboratório, os oócitos e os espermatozóides são colocados no interior das trompas de Falópio através de laparoscopia para que aí se dê a fecundação. Neste caso, a fecundação é in vivo.
A paciente poderá ir para casa em poucas horas.
A GIFT tem uma taxa de sucesso da ordem dos 25-30%. No entanto, cerca de um terço das gravidezes são múltiplas.
Transferência intratubárica de zigotos ou ZIFT (Zygote Intrafallopian Transfer)
 Esta técnica é uma variante da GIFT. Na ZIFT, após recolha e selecção de oócitos e espermatozóides, pelas mesmas técnicas da FIV, os gâmetas são postos em contacto in vitro, num meio de cultura adequado durante 18 a 24 horas. Após a fecundação, realiza-se uma laparoscopia e transfere-se o(s) zigoto(s) para as trompas de Falópio.
Esta técnica é uma variante da GIFT. Na ZIFT, após recolha e selecção de oócitos e espermatozóides, pelas mesmas técnicas da FIV, os gâmetas são postos em contacto in vitro, num meio de cultura adequado durante 18 a 24 horas. Após a fecundação, realiza-se uma laparoscopia e transfere-se o(s) zigoto(s) para as trompas de Falópio.
Relativamente à FIV, a ZIFT tem a mesma ou pior taxa de sucesso, daí que esta técnica não seja das mais utilizadas.
Maternidade de substituição
Este método tem aplicação na esterilidade feminina por impossibilidade de gestação, devido, por exemplo, à ausência de útero.
Consiste na geração de um ser por outra mulher (a receptora), que não seja a sua mãe genética (a doadora). Daí a expressão "mãe substituta" ou “barriga de aluguer” para designar a mulher fértil que se dispõe, mediante a formalização de um contrato, a carregar o embrião dentro do seu útero, devido à infertilidade da outra mulher, até ao seu nascimento, ocasião em que o entregará ao casal que a contratou.
Para tal, pratica-se uma fecundação in vitro ou ICSI com gâmetas do casal com posterior colocação no útero de acolhimento ou ainda por inseminação artificial com espermatozóides do elemento masculino do casal, sendo o oócito fornecido pela “mãe de substituição”.
Histeroscopia e Laparoscopia
Na laparoscopia, é feita uma pequena incisão no umbigo e é introduzido um telescópio fino (laparoscópio), que é um instrumento de fibra óptica que permite realizar procedimentos diagnósticos e terapêuticos.
Actualmente, existe um procedimento designado de videolaparoscopia em que a visualização interna é feita através de câmaras de vídeo minúsculas, o que permite uma maior definição dos procedimentos.
Ambos os procedimentos necessitam de anestesia geral e internamento hospitalar.
A histeroscopia é uma endoscopia uterina, ou seja, é um exame que permite ver a parede interna do útero, através de um histeroscópio, podendo a paciente acompanhar todo o processo através de um televisor. Com este processo podem-se diagnosticar e tratar diversas causas de infertilidade (tumores, pólipos, entre outros).
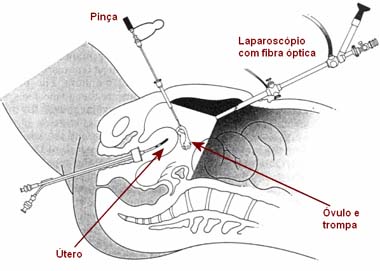 Laparoscopia
Laparoscopia |
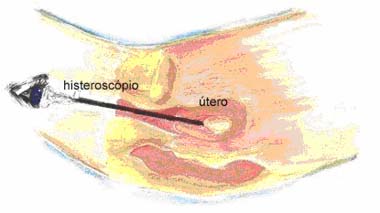 Histeroscopia
Histeroscopia |
Indução da Ovulação
A indução da ovulação é uma etapa importante em todos os processos de reprodução assistida, para que haja uma maior produção de oócitos II e, consequentemente, maiores hipóteses de gravidez.
Neste tratamento, a indução é realizada com o uso de medicamentos que actuam na hipófise ou que actuam directamente nos ovários, estimulando a ovulação. Estes medicamentos aumentam a oferta da hormona folículo-estimulina (FSH) aos ovários durante um certo período de tempo, o que vai estimular o crescimento dos folículos.
Como já foi estudado no âmbito da disciplina de Biologia, durante um ciclo ovárico espontâneo, de todos os folículos seleccionados a cada mês (cerca de dez), apenas um alcança a maturação e é denominado folículo maduro ou de Graaf. Os restantes folículos entram em atrofia e nunca mais voltarão a desenvolver-se. Em ocasiões extraordinárias, são seleccionados mais de um folículo, com a consequente produção de mais de um oócito II. Isto pode levar à formação de gémeos não idênticos, no caso de ocorrer fecundação.
O objectivo da estimulação do ovário no caso da reprodução assistida é obter um maior número de oócitos nos dois ovários e evitar a atrofia dos folículos que entram em desenvolvimento, permitindo um maior número de oócitos disponíveis. O controlo para que se obtenha somente o número de oócitos desejados é feito através de ecografia transvaginal e dosagem de hormonas. O destino destes oócitos vai depender depois da técnica de reprodução assistida a ser utilizada.

Corte de ovário
O tipo de procedimento a ser aplicado, bem como as dosagens a serem usadas, devem ser ajustadas à sensibilidade dos folículos ao FSH, à idade da paciente e ao facto da paciente ser ou não anovulatória crónica, evitando-se desta maneira a falta de ovulação quando a quantidade utilizada é menor do que a necessária, ou gestação múltipla quando for além do necessário. No caso da fertilização in vitro, por exemplo, realiza-se uma hiperovulação, com o objectivo de se obter um maior número de óvulos, sendo depois colhidos, seleccionados e transferidos somente os necessários, evitando-se assim a gestação múltipla. Em caso de se obter um número maior que o desejado, os oócitos II serão congelados.
Criopreservação de gâmetas e embriões
O que é afinal a Criobiologia? Para que serve?
A criobiologia é o estudo dos processos de congelação de células e tecidos e permite a preservação de células por tempo prolongado e mantém as propriedades biológicas destas depois de descongeladas. A tecnologia desenvolveu protocolos de congelação/descongelação eficientes que permitem preservar células e tecidos a temperaturas até -196ºC geralmente sem afectar ou com muito pouco efeito na sua estrutura e funcionalidade.
Criopreservação dos Espermatozóides
A Criopreservação do esperma é uma técnica utilizada desde a década de 50 e representa uma valiosa opção terapêutica no tratamento da infertilidade. As principais indicações incluem:
Criopreservação de Embriões
Esta técnica é realizada quando há produção de mais embriões do que o necessário para a transferência. Apenas aqueles de boa qualidade têm maior oportunidade de sobrevivência. Os embriões excedentários são colocados numa solução especial com uma substância chamada crioprotector, que evita que os embriões sejam danificados com o frio excessivo; são então colocados em botijas de azoto líquido, onde a temperatura chega a 196ºC negativos e podem permanecer aí por tempo indeterminado.
Apesar dos embriões apresentarem menor taxa de sobrevivência do que os embriões a fresco, esta técnica oferece a vantagem de uma nova oportunidade com menor custo. Os embriões são descongelados 24 horas antes da transferência, cultivados e são, posteriormente, estudados quanto à sua viabilidade.
Criopreservação de Oócitos
A criopreservação de oócitos humanos ainda é uma metodologia em desenvolvimento, apesar de algumas gestações pós-descongelamento terem sido descritas em meados da década de 80.
Desde que as técnicas para a criopreservação de oócitos foram, e ainda estão a ser, descritas, os cientistas estão a investir cada vez mais nessa tecnologia. Abriram-se a partir de então possibilidades para a formação de um banco de oócitos. Esses oócitos poderão ser armazenados e usados no futuro, especialmente para mulheres que não possuem ovários ou que apresentaram menopausa precoce. Esta tecnologia também oferece uma oportunidade a pacientes que serão submetidas a tratamento de cancro, aumentando assim a eficácia de tratamentos de reprodução medicamente assistida.
Pacientes que serão submetidas a tratamentos de FIV ou ICSI que obtiverem um grande número de oócitos poderão congelar os excedentes e utilizá-los numa outra tentativa ou ainda doá-los a um banco de oócitos, facilitando também as implicações éticas e religiosas que envolvem o congelamento de embriões.
Após ser relatado o primeiro nascimento de um bebé (Chen, 1986), vários pesquisadores, inúmeras técnicas e tentativas estão a ser relatadas sobre o sucesso desta biotecnologia.
Várias técnicas já estão a ser utilizadas em Portugal, no entanto os resultados ainda são poucos. Acredita-se que em breve esta tecnologia já seja rotina nas clínicas de fecundação in vitro. Entretanto algumas desvantagens da técnica ainda devem ser contornadas. Acredita-se que o fuso mitótico (estrutura que segura o material genético do oócito maduro) é sensível a mudanças de temperatura, e os erros genéticos podem ocorrer durante o processo de congelamento, resultando em aneuploidias após a fertilização. Alguns trabalhos também referem um aumento da libertação de grânulos corticais que levariam a um endurecimento da zona pelúcida (Trounson e Kirby, 1989) alterando os resultados da fecundação in vitro. Até ao momento, não é satisfatória a taxa de sobrevivência dos oócitos humanos descongelados, os índices de sucesso variam de 27% a 64%. Em geral, os índices de fertilização dos oócitos descongelados são inferiores aos obtidos com a inseminação a fresco e uma incidência alta de fertilização anormal tem sido referida.
Hoje uma técnica de congelação ultra-rápida descrita como vitrificação está a ser bastante empregada para criopreservar os oócitos e está a apresentar excelentes resultados. O único impedimento para a realização desta tecnologia é a baixa sobrevivência dos oócitos após o descongelamento, mas é um impasse que já está a ser resolvido e em breve fará parte da rotina das clínicas de reprodução assistida.
 Congelando embriões
Congelando embriões |
 Aparelho de congelação de sémen e embriões
Aparelho de congelação de sémen e embriões |
Para evitar doenças ligadas ao sexo, cromossomas, ou mesmo doenças genéticas é possível a análise dos cromossomas ou mesmo de uma fracção dos genes através da técnica de Diagnóstico Genético Pré-Implantatório.
Um blastómero é retirado do embrião (biópsia embrionária) durante os procedimentos envolvidos na Fertilização In Vitro e analisado. Isto ocorre sem danificação do embrião. Existem duas técnicas para análise, a técnica de FISH (fluorescent in situ hybridization) para diagnóstico de alterações cromossómicas tais como síndrome de Down, e a técnica de PCR (Polymerase Chain Reaction) para detectar mudanças estruturais nos genes. Desta forma, doenças hereditárias, desde que identificadas previamente na família, podem ser evitadas através destas técnicas.
O PGD é um procedimento tecnicamente desafiador, que exige um bom entendimento de embriologia e biologia molecular. Durante a FIV, os óvulos e os pré-embriões em estágios precoces de clivagem são facilmente acessíveis permitindo, portanto, uma ou mais biópsias dessas células. No entanto, a quantidade de material genético, suficientemente segura, para a realização dos testes, permanece ainda limitada para a confirmação de diagnósticos.
 Apesar dessas barreiras, o PGD tem-se tornado, rapidamente, parte integral de muitos programas de FIV. Até ao presente momento, há cerca de 30 centros em todo mundo, que oferecem o PGD para pacientes seleccionados.
Apesar dessas barreiras, o PGD tem-se tornado, rapidamente, parte integral de muitos programas de FIV. Até ao presente momento, há cerca de 30 centros em todo mundo, que oferecem o PGD para pacientes seleccionados.
Até agora, as três maiores aplicações do PGD são:
Biópsia do corpúsculo polar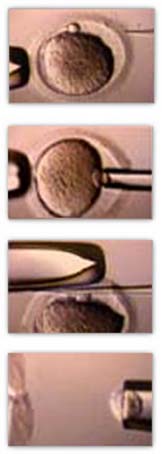
O primeiro aspecto crítico do PGD é a obtenção de material genético suficientemente informativo sem danificar o potencial de desenvolvimento do embrião. Esses esforços podem incluir a biópsia do primeiro glóbulo polar (ou, para se ser mais preciso, diagnóstico genético pré-concepcional), a biópsia do segundo glóbulo polar, a biópsia de blastómeros em estágio de clivagem ou a biópsia de células do trofoblasto. Teoricamente, a biópsia de células do trofoblasto representa o procedimento com melhor potencial para recuperar quantidade suficiente de células para análise genética comparado a outros métodos. No entanto, a biópsia do primeiro glóbulo polar e a biópsia de blastómeros continuam a ser os métodos preferidos na maioria das clínicas de reprodução assistida. Os detalhes técnicos específicos para a biópsia tendem a ser desenvolvidos de acordo com as preferências pessoais e experiência do embriologista.
FISH (Fluorescent in situ Hibridization)
Como mencionado anteriormente, o material genético para análise está limitado a uma ou duas estruturas (glóbulos polares, um ou dois blastómeros). Além disso, a biópsia do glóbulo polar não é aplicável se a(s) doença(s) genética(s) em questão são transmitidas pelo homem. A análise cromossómica directa é realizada somente no primeiro ou segundo glóbulos polares porque, nos estágios mais precoces de clivagem (6 a 10 células), raramente se obtêm cromossomas em metafase. A técnica da FISH, que foi desenvolvida somente na última década, permite a determinação do número de cromossomas específicos, através da contagem de sinais específicos nos núcleos em interfase. Esta técnica é muito sensível e tem alta exactidão.
PCR (Polimerase Chain Reaction) para detecção de defeitos em um único gene
A técnica da PCR revolucionou a análise do DNA. O procedimento envolve repetidas amplificações do DNA para obtermos cópias adequadas para análise. O uso desta técnica permite detectar mutações num só gene, em glóbulos polares ou blastómeros. O DNA amplificado pode ser submetido a análise de mutações através de  vários métodos, cuja selecção é determinada pelas características da mutação investigada.
vários métodos, cuja selecção é determinada pelas características da mutação investigada.
Embora a lista de doenças passíveis de investigação pela PCR-PGD esteja a crescer muito rapidamente, ainda existem muitos problemas inerentes à técnica. O controle de contaminação de DNA é de importância crucial. Mesmo quantidades diminutas de DNA estranho contaminante tem efeitos adversos sobre todo o método, já que tal material seria amplificado junto com o molde original do espécime biopsiado. As técnicas necessárias para se produzir um resultado fiável e "limpo" devem ser rigorosamente mantidas, e um local isolado é pré-requisito para se estabelecer um laboratório de PCR.
A Fibrose Cística e a anemia falciforme são as duas doenças comummente identificadas por PCR nos casos de PGD. A amplificação total do genoma tem potencial para permitir análise genética de múltiplos loci.
Perspectivas futuras
A aplicação do PGD envolve novas e desafiantes técnicas clínicas, e, por esse motivo, é provável que permaneça em fase de pesquisa por vários anos. No entanto, num futuro próximo, o PGD tornar-se-á mais importante e mais extensamente usado, pelas seguintes razões:
mais extensamente usado, pelas seguintes razões:
Os principais riscos comportados pela concepção assistida são:
Foi crescente, na última década, o número de mulheres portuguesas a optar pela maternidade depois dos 30 anos ignorando o pico da fertilidade feminina, situado entre os 20 e os 25 anos, e arriscando a partir dos 35. 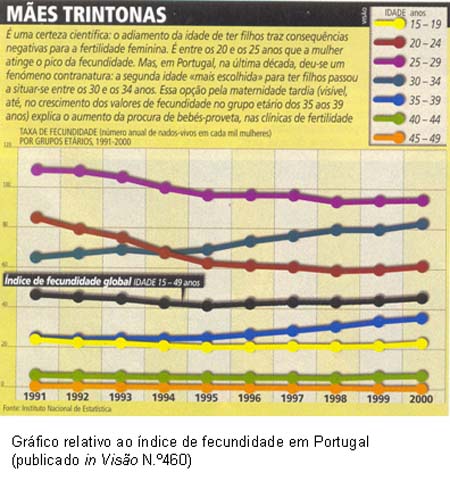 Isto deve-se sobretudo ao aumento do número de mulheres que tiram cursos superiores e que constroem carreiras, adiando o nascimento do primeiro filho.
Isto deve-se sobretudo ao aumento do número de mulheres que tiram cursos superiores e que constroem carreiras, adiando o nascimento do primeiro filho.
Paralelamente, acentuou-se o estrangulamento dos serviços públicos de reprodução assistida, com listas de espera de dois anos, incomportáveis para os casais desejosos de procriar.
Por isso, proliferaram no país as clínicas privadas, com respostas quase imediatas e variadas, e altas taxas de sucesso. Em Lisboa, são já 6, contra duas alternativas do Serviço Nacional de Saúde, enquanto no Porto, existem 3 ofertas públicas e 3 privadas.
Em Portugal, a primeira lei (n.º 32/2006) sobre a reprodução medicamente assistida foi aprovada em Maio do presente ano e apenas permite a procriação assistida a casais heterossexuais, casados ou a viver em união de facto registada (com pelo menos dois anos). Na sequência da promulgação desta lei, o Instituto de Ciências Biomédicas Abel Salazar (ICBAS) abriu, desde Setembro deste ano, um banco público de armazenamento de espermatozóides e óvulos.
Em condições ideais, 5 a 6 mil bebés poderão vir a nascer, por ano, em Portugal, graças à reprodução assistida, compondo o índice de fecundidade que, em 2000 registou um valor de 1,52 crianças por mulher, bastante abaixo do nível de substituição das gerações (2,1 crianças por mulher).
O progresso nas técnicas de reprodução assistida, embora consiga responder ao desejo de numerosos casais estéreis, tem levantado várias questões morais que põem em causa a legitimidade dos progressos científicos feitos nesta área.
Os aspectos éticos mais consideráveis são os que se referem à selecção do sexo, à doação de espermatozóides, oócitos e embriões, à selecção de embriões com base na evidência de doenças ou problemas associados, à maternidade substitutiva, às situações de monoparentalidade, à clonagem ou modificações genéticas no embrião, ao destino dos embriões excedentários e à pesquisa e criopreservação de embriões.
Existe ainda o problema que se levanta relativamente a aspectos reprodutivos de casais homossexuais. Se casais homossexuais femininos solicitarem um serviço de reprodução assistida, em que uma das parceiras utilizando esperma do dador, deve a comunidade médica equiparar esta solicitação à de um casal heterossexual? Ou deve ser feita uma abordagem totalmente diferente?
Deve realizar-se uma fecundação estritamente “artificial” quando a natureza não o permitiu? Que pensar quando os embriões congelados são destruídos após a fecundação? Não se está a destruir um potencial ser humano?
Uma coisa é certa: nenhuma decisão, a este nível, deverá ser tomada de ânimo leve ou tendo apenas em conta uma única perspectiva sobre o problema.
Com a realização deste trabalho, foi possível aumentar e aprofundar conhecimentos na área da Reprodução Medicamente Assistida, tema bastante debatido nos dias que correm.
Pensamos que os objectivos globais a que nos propusemos com este trabalho foram atingidos, nomeadamente a apresentação e explicação das diferentes técnicas de concepção assistida.
Abordámos ainda a situação desta problemática em Portugal, bem como o tema da infertilidade.
Para além disso, foi proveitoso o contacto que tivemos com estes assuntos no campo da Bioética, a qual assume cada vez maior importância no controlo da Ciência, à medida que esta progride.
Em suma, esperamos que seja possível recolher deste trabalho dividendos positivos e que a sua leitura não seja maçuda e que dela seja possível retirar informações claras e concisas que ajudem a uma melhor compreensão do que será tratado nas aulas de Biologia acerca deste assunto.
AAVV (1987). ABC do Corpo Humano. Lisboa: Selecções do Reader’s Digest.
AAVV (2004). Diciopédia 2005, Porto: Porto Editora Multimédia.
AAVV (1992). Nova Enciclopédia Portuguesa (vol. 24). Lisboa: Ediclube.
AAVV (2005). Biologia 12 CD-ROM, Porto: Areal Editores.
IBOR, Lopéz (1974). Livro da Vida Sexual, Lisboa: Celbrasil.
MATIAS, Osório; Martins, Pedro (2006). Biologia 12, Porto: Areal Editores.
Revista Notícias Magazine n.º 750: 08-10-2006
Revista VISÃO n.º 460: 27-10-2001