Home » 3º Ciclo » 9º Ano » Físico-Química » Tabela Periódica
Tabela Periódica
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Vitor Mina e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Resumo do trabalho
Trabalho sobre a Tabela Periódica, incluindo a evolução da sistematização dos elementos químicos e a sua organização atual.
Evolução da sistematização dos elementos químicos:
Tabela Periódica
Introdução
Com este trabalho pretendo demonstrar a evolução pela qual a tabela periódica passou até aos dias atuais e também como está organizada atualmente. A metodologia utilizada neste trabalho foram livros mas também a Internet. Este trabalho foi realizado no Âmbito da disciplina de Físico Química.
Quais foram os antecedentes à Tabela Periódica?
O livro Traité Élémentaire de Chimie (1789) de Antoine Lavoisier foi considerado o passo inicial para o começo do estudo dos elementos químicos quando neste foi publicada uma lista com 33 substâncias elementares, isto é que não podiam ser decompostas em reações químicas, e das quais muitas fazem parte da tabela periódica atual. Lavoisier classificou esses elementos em quatro grupos: substâncias simples, metálicas, não-metálicas e salificáveis ou terrosas.
A primeira Tabela Periódica
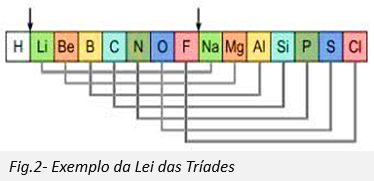
Em 1817, Döbereiner apercebeu-se que muitos elementos podiam ser agrupados em tríades, isto é um grupo de três elementos, baseando-se nas suas propriedades químicas. Lítio, Sódio e Potássio, por exemplo, foram agrupados juntos como um tríade de metais reativos frágeis. Döbereiner também reparou que, quando arranjados pela massa atómica relativa, o segundo membro de cada tríade tinha aproximadamente a média do primeiro elemento com o terceiro, o que ficou conhecido como a Lei das tríades.
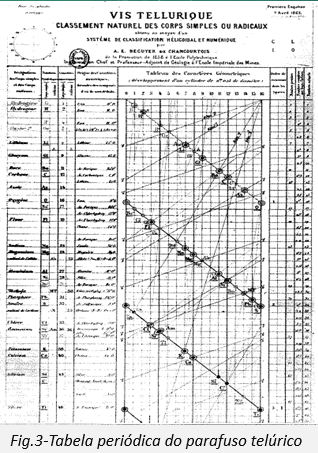
Em 1862, o geólogo francês Alexandre-Emile Béguyer de Chancourtois publicou uma forma de tabela periódica chamada de parafuso telúrico, sendo o primeiro a notar a periodicidade dos elementos. Com este arranjo em espiral ordenada por massa atómica relativa no cilindro, Chancourtois demonstrou que os elementos tinham propriedades similares que pareciam ocorrer em intervalos regulares.
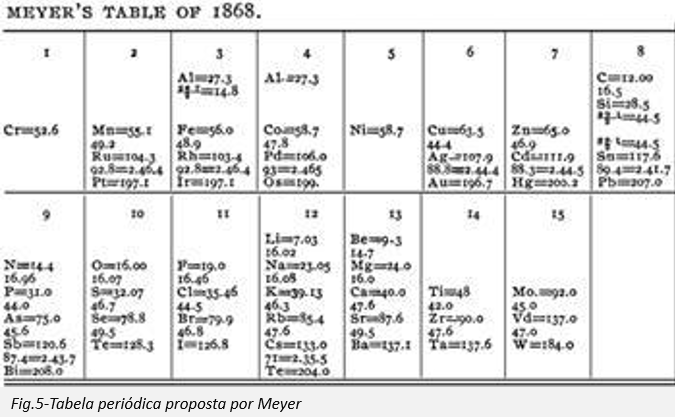
Em 1864, o químico alemão Julius Lothar Meyer publicou uma tabela com 44 elementos arranjados pelo conceito da valência. Concomitantemente, o químico inglês William Odling publicou um arranjo de 57 elementos ordenados com base nas suas massas atómicas relativas. Apesar de algumas irregularidades e espaços, ele notou que parecia haver uma periodicidade de massas atómicas entre os elementos.
A segunda Tabela Periódica
O químico inglês John Newlands publicou uma série de artigos entre 1863 e 1866 notando que quando os elementos eram listados em ordem crescente de massa atómica, propriedades físicas e químicas ocorriam em intervalos de oito, o que ele ligou a periodicidade das oitavas na escala musical.
Embora a tabela original proposta tivesse algumas falhas e contradições, a Royal Society somente reconheceu a importância das descobertas de Newlands cinco anos depois de terem publicado o trabalho de Mendeleev, entregando-lhe a Medalha Davy pela sua contribuição.

A Tabela Periódica de Mendeleev e Meyer
O professor de química russo Dmitri Mendeleev e Meyer publicaram de forma independente tabelas periódicas em 1869 e 1870, respetivamente. A tabela de Mendeleev foi a primeira versão enquanto a de Meyer foi uma versão expandida da tabela publicada em 1864. Ambos construíram as suas tabelas listando os elementos em linhas ou colunas ordenados pela massa atómica e começando uma nova coluna ou linha quando as características dos elementos começavam repetir-se.
A descoberto do número atómico
No final século XIX houve um avanço significativo na teoria atómica com as descobertas dos Raios-X por Wilhelm Rontgen e da radioatividade natural por Henri Becquerel por volta de 1895. Frederick Soddy e Ernest Rutherford constataram que as emissões radioativas dos elementos resultavam em elementos químicos diferentes, o que levou á conclusão de que a massa atómica não era uma propriedade do átomo adequada para indicar a periodicidade dos elementos químicos. Conforme o demonstrado por Soddy, o mesmo elemento químico poderia ter uma massa atómica diferente, condição denominada por isótopos.
Em 1913, o cientista britânico Henry Moseley descobriu uma relação exata entre as linhas espectrais fora da região do visível com um número ordinal, denominando o número atómico, que posteriormente constatou-se ser o número de protões do núcleo. Quando os átomos foram arranjados de acordo com o aumento do número atómico, as inconsistências existentes na tabela de Mendeleev desapareceram. Devido ao trabalho de Moseley, a tabela periódica moderna está baseada no número atómico dos elementos. Atualmente existem 118 números atómicos.
As últimas modificações na Tabela Periódica
Em 1871, Mendeleev publicou uma forma atualizada da tabela periódica, fornecendo informações detalhadas das suas previsões para os elementos que faltavam mas que deveriam existir. Estes espaços foram subsequentemente preenchidos conforme os químicos descobriram os elementos naturais que existiam.
O formato popular da tabela periódica, também conhecido como forma comum ou padrão, é atribuído ao químico americano Horace Groves Deming. Em 1923, Deming publicou uma versão curta semelhante à de Mendeleev, com uma média de dezoito colunas.
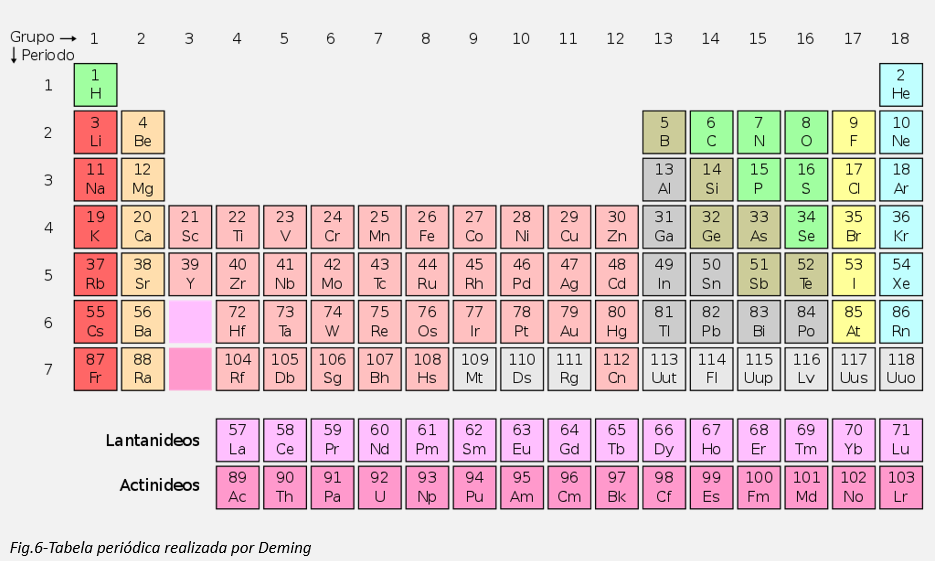
Em 1945 o cientista americano Glenn Seaborg sugeriu que os elementos actinídeos estavam a preencher o subnível f assim como os lantanídeos. Antes disso, acreditavam-se que os actinídeos formavam uma quarta linha do subnível d. Os colegas de Seaborg sugeriram que ele não publicasse uma sugestão tão radical pois poderia arruinar a sua carreira. Entretanto, a sugestão de Seaborg estava correta e ele foi subsequentemente premiado com o prémio Nobel de química em 1951 pelo seu trabalho na síntese dos elementos actinídeos.
Em 2016, novos elementos químicos da tabela foram oficializados como: o Tenessino, o Nihónio, o Moscóvio e o Oganesson.
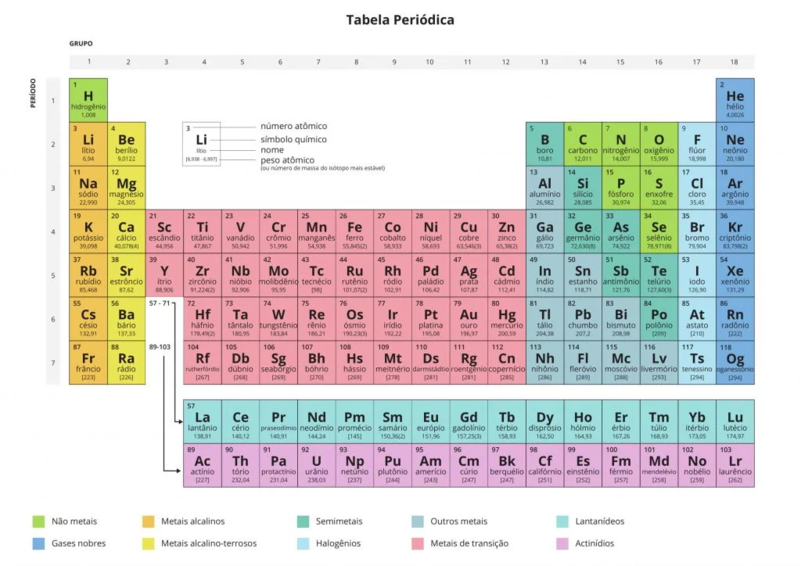
Como está organizada atualmente a Tabela Periódica?
São dezoito Grupos (A e B), sendo que as famílias mais conhecidas são as do Grupo A:
- Família 1A: Metais Alcalinos (lítio, sódio, potássio, rubídio, césio e frâncio).
- Família 2A: Metais Alcalinoterrosos (berílio, magnésio, cálcio, estrôncio, bário e rádio).
- Família 3A: Família do Boro (boro, alumínio, gálio, índio, tálio e nihónio).
- Família 4A: Família do Carbono (carbono, silício, germânio, estanho, chumbo e fleróvio).
- Família 5A: Família do Nitrogénio (nitrogénio, fósforo, arsénio, antimónio, bismuto e moscóvio).
- Família 6A: Calcogénios (oxigénio, enxofre, selénio, telúrio, polónio, livermório).
- Família 7A: Halogénios (flúor, cloro, bromo, iodo, astato e tenessino).
- Família 8A: Gases Nobres (hélio, néon, árgon, crípton, xénon, rádio e oganesson).
Os elementos de transição, também chamados de metais de transição, representam as 8 famílias do Grupo B:
- Família 1B: cobre, prata, ouro e roentgénio.
- Família 2B: zinco, cádmio, mercúrio e copernício.
- Família 3B: escândio, ítrio e sério de lantanídeos (15 elementos) e actinídeos (15 elementos).
- Família 4B: titânio, zircónio, háfnio e rutherfórdio.
- Família 5B: vanádio, nióbio, tântalo e dúbnio.
- Família 6B: crómio, molibdênio, tungstênio e seabórgio.
- Família 7B: manganês, tecnécio, rénio e bóhrio.
- Família 8B: ferro, ruténio, ósmio, hássio, cobalto, ródio, irídio, meitnério, níquel, paládio, platina, darmstádio.
Os elementos químicos também estão organizados segundo as suas propriedades existindo 10 categorias diferentes, sendo elas:
- Os Alcalinos
- Os Alcalinos-Terrosos
- Os metais de Transição
- Os Halogénios
- Os semimetais
- Os não metais
- Outros Metais
- Os Gases Nobres
- Os lantanídeos
- Os actinídeos
Conclusão
Com este trabalho espero que tenham percebido a evolução da tabela periódica assim como as pessoas que contribuíram para a mesma, além disso também espero que tenham ficado saber mais quanto á sua organização.
Web grafia/Bibliografia
- Http://iupac.org/cms/wp-content/uploads/2015/07/IUPAC_Periodic_Table-28Nov16.jpg
- Https://www.infoescola.com/quimica/historia-da-tabela-periodica/
- https://pt.wikipedia.org/wiki/Hist%C3%B3ria_da_tabela_peri%C3%B3dica
- Rugi, Roberto (s.d.).Química. Lisboa: Hiperlivro
- Rugi, Roberto (s.d.).A matéria. Lisboa: Hiperlivro
409 Visualizações
16/06/2019





 Em 1864, o químico alemão Julius Lothar Meyer publicou uma tabela com 44 elementos arranjados pelo conceito da valência. Concomitantemente, o químico inglês William Odling publicou um arranjo de 57 elementos ordenados com base nas suas massas atómicas relativas. Apesar de algumas irregularidades e espaços, ele notou que parecia haver uma periodicidade de massas atómicas entre os elementos.
Em 1864, o químico alemão Julius Lothar Meyer publicou uma tabela com 44 elementos arranjados pelo conceito da valência. Concomitantemente, o químico inglês William Odling publicou um arranjo de 57 elementos ordenados com base nas suas massas atómicas relativas. Apesar de algumas irregularidades e espaços, ele notou que parecia haver uma periodicidade de massas atómicas entre os elementos.


 Em 1945 o cientista americano Glenn Seaborg sugeriu que os elementos actinídeos estavam a preencher o subnível f assim como os lantanídeos. Antes disso, acreditavam-se que os actinídeos formavam uma quarta linha do subnível d. Os colegas de Seaborg sugeriram que ele não publicasse uma sugestão tão radical pois poderia arruinar a sua carreira. Entretanto, a sugestão de Seaborg estava correta e ele foi subsequentemente premiado com o prémio Nobel de química em 1951 pelo seu trabalho na síntese dos elementos actinídeos.
Em 2016, novos elementos químicos da tabela foram oficializados como: o Tenessino, o Nihónio, o Moscóvio e o Oganesson.
Em 1945 o cientista americano Glenn Seaborg sugeriu que os elementos actinídeos estavam a preencher o subnível f assim como os lantanídeos. Antes disso, acreditavam-se que os actinídeos formavam uma quarta linha do subnível d. Os colegas de Seaborg sugeriram que ele não publicasse uma sugestão tão radical pois poderia arruinar a sua carreira. Entretanto, a sugestão de Seaborg estava correta e ele foi subsequentemente premiado com o prémio Nobel de química em 1951 pelo seu trabalho na síntese dos elementos actinídeos.
Em 2016, novos elementos químicos da tabela foram oficializados como: o Tenessino, o Nihónio, o Moscóvio e o Oganesson.